Алкины
Введение
Может показаться, что органическая химия нарочно издевается: алканы, алкены, а теперь ещё не легче. Названия отличаются всего на одну букву, а классы разные. Ничего-ничего, попробуем и с алкинами разобраться. Спойлер: есть ещё алкадиены, но о них в другой раз.
Алкины — это непредельные, ненасыщенные углеводороды, в молекулах которых между двумя атомами углерода есть тройная связь.
Выглядит это так: НС≡СН.
В примере этин или ацетилен, он родоначальник всех алкинов.
Номенклатура алкинов и гомологический ряд
Есть общая формула алкинов, выглядит она так:
CₙH₂ₙ₋₂
где:
С – атом углерода
H – атом водорода
n≥2
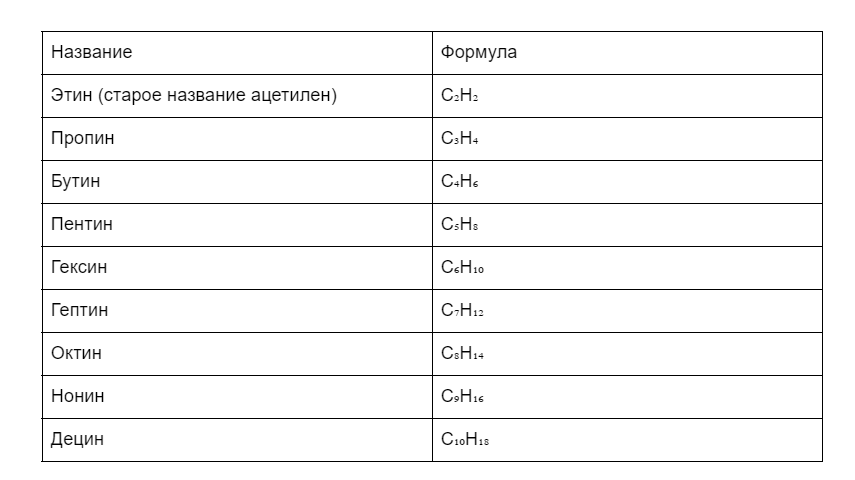
Все названия идентичны гомологическому ряду алканов. Просто заменили окончания на -ин.
Строение алкинов
Как уже упоминали, у алкинов между двумя атомами углерода есть тройная связь. Для этого атомы углерода находятся в состоянии sp-гибридизации. Это значит что s- и p-орбитали объединяются и несколько видоизменяются, с образованием одинаковых гибридных орбиталей, которые находятся под углом 180°. Особенность же тройной связи в том, что она короче по длине, чем двойная. А также тройная связь состоит из одной σ-связи и двух π-связей, которые расположены в двух перпендикулярных плоскостях.
Изомерия
Для удобства изучения мы собрали виды изомерии в таблице:
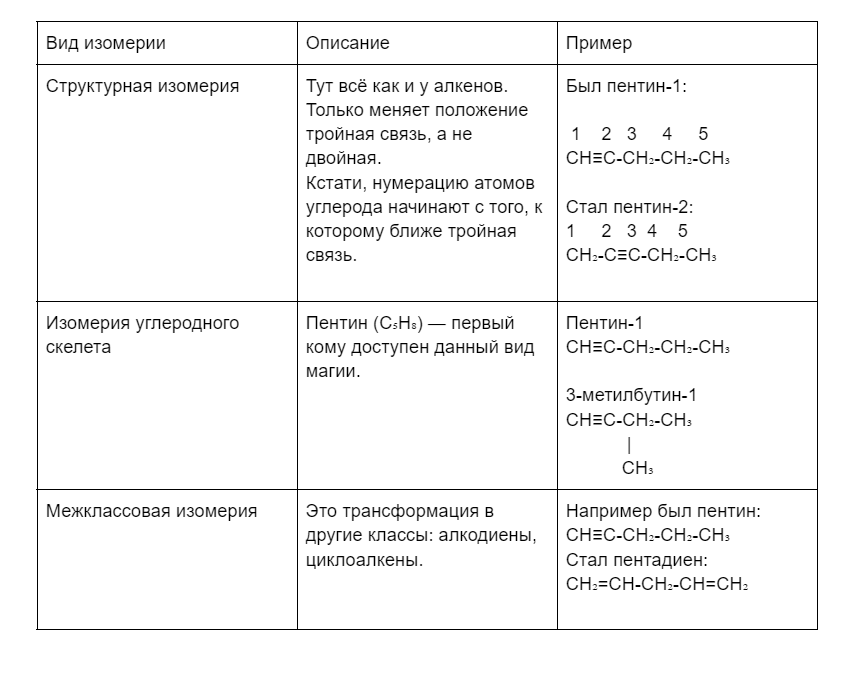
Алкинам с длинной углеродной цепью присуща оптическая изомерия. А вот цис- и транс-изомерия не свойственна. И за это все алкины хочется от души обнять.
Физические свойства алкинов
- C₂H₂ – C₄H₆ — газы без цвета и запаха.
- C₅H₈ – C₁₆H₃₀ — жидкости.
- с C₁₇H₃₂ — твердые вещества.
В целом физические свойства алкинов очень похожи на свойства собратьев -кенов и -канов. Только кипят и плавятся лучше. Например пропил кипит при -23C, а его друг алкан пропан при -42C.
Как и все углеводороды алканы мало растворяются в воде, но великолепно в органических растворителях.
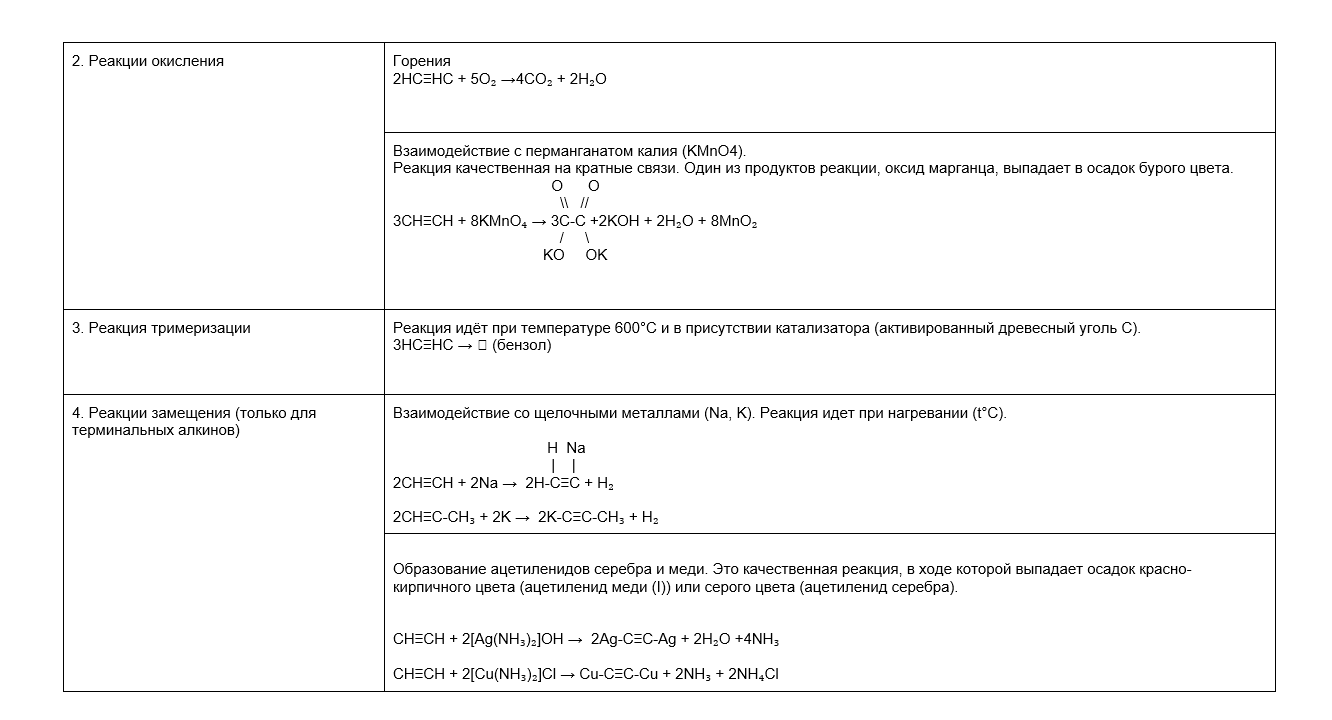
Химические свойства алкинов
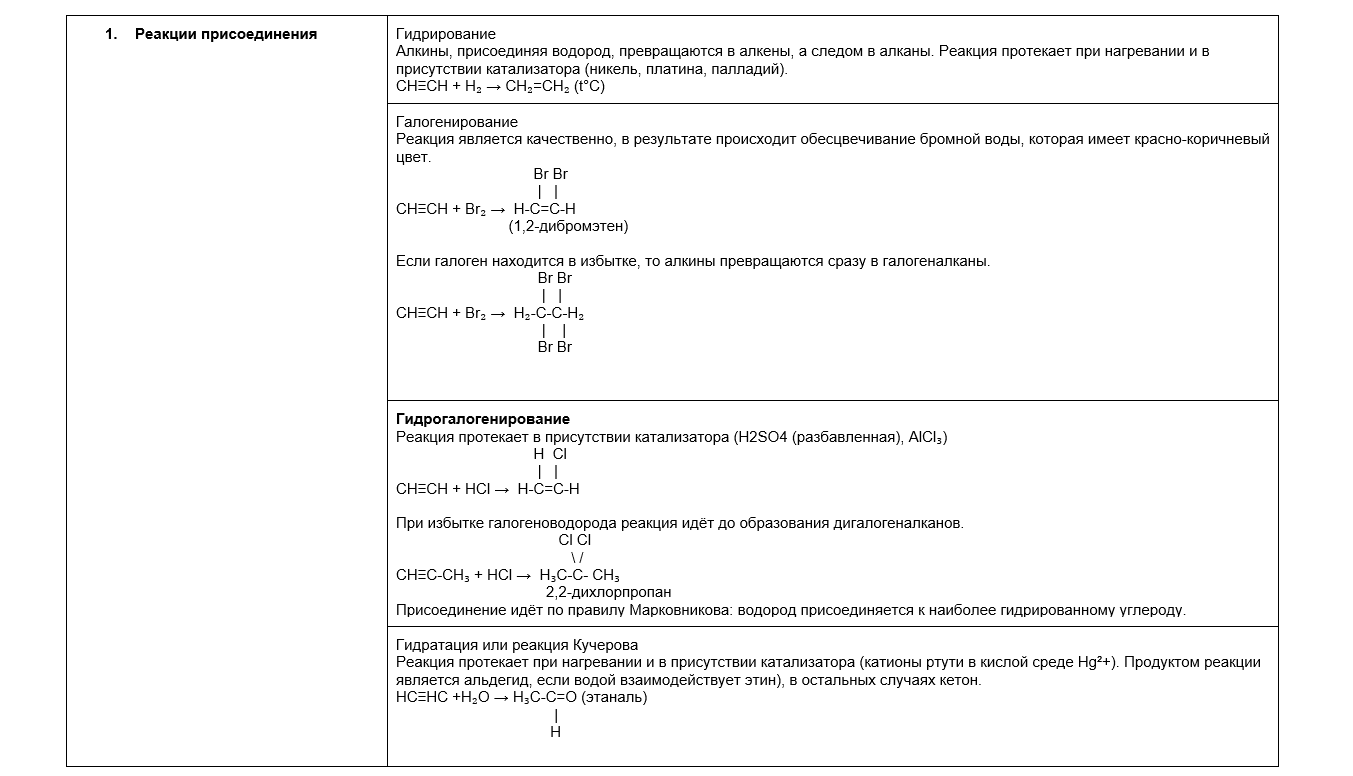
Для удобства химические свойства мы тоже собрали в таблице:
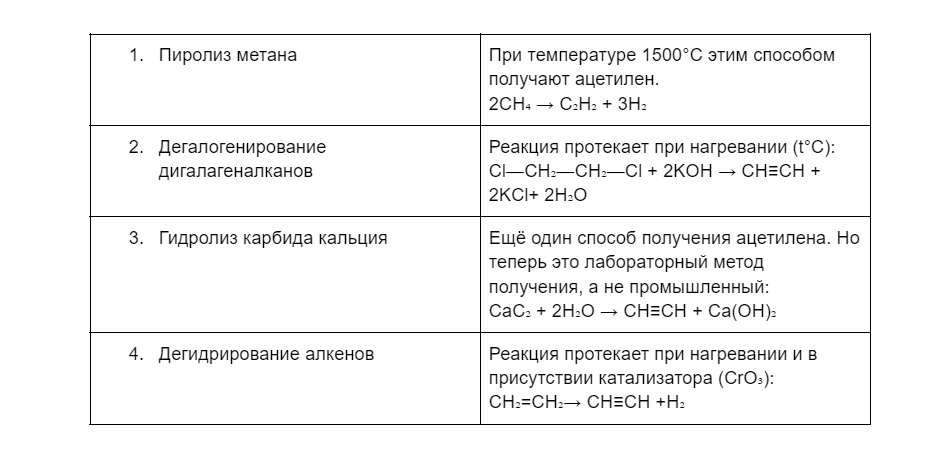
Получение алкинов
Как бы это грустно не звучало, алкины в природе днем с огнем не сыщешь. Точнее их нашли в мизерных количествах у какого-то вида грибов, а ещё в атмосфере планет-гигантов, но человечеству от этого не легче. Поэтому рассмотрим в таблице несколько реальных методов изготовления алкинов.
Применение алкинов
Алкины используются в промышленности для синтеза других органических соединений (альдегидов, кетонов и т.д.), и их полимеров, например поливинилхлорида (ПВХ), синтетического каучука, поливинилацетата (клей ПВА).
Самый ходовой алкин — это конечно же ацетилен. Он одно время даже применялся для наркоза под названием нарцилен. Ещё ацетилен используется в кислородно-ацетиленовой сварке и резке металлов.
Проверь себя
Чем алкины отличаются от алканов?
- Двойной связью
- Тройной связью
- Ничем.
Как будет называться C₇H₁₂?
- Гептен
- Гептан
- Гептин
Какое агрегатное состояние будет у C₄H₆?
- Жидкость
- Газ
- Твердое вещество