Алкены

Введение
Органическая химия или, как ее ещё называют, химия углерода — темна и полна различных классов. Алкены один из них. Если алканы (тут можно сделать ссылку на статью с алканами) были насыщенными и предельными, то алкены совсем наоборот: ненасыщенные и непредельные.
Попробуем разобраться на примерах, что это значит.
Строение
Как известно, углерод в органической химии находится в возбужденном состоянии и всегда имеет валентность IV. Это значит, что он будет образовывать четыре химических связи. Для примера посмотрим на формулу этана:
H H
| |
H— C — C — H
| |
H H
Все валентности закрыты, то есть достигнут предел по σ-связям.
У алкенов же присутствует двойная химическая связь, причем одна будет σ, а другая π, формула представителя будет следующей, это этилен:
H— C = C — H
| |
H H
Атомы углерода, участвующие в образовании двойной связи, находятся в sp² гибридизации. А гибридные орбитали находятся под углом <120°. π-связь находится перпендикулярно по отношению к σ-связям, то есть находится совсем в другой плоскости. Из-за чего молекула имеет плоскую тригональную форму.
Но стоит обратить внимание, что эта такая характеристика будет только у той части молекулы где есть двойная связь. Если мы возьмём гомолога с углеродной цепью, где больше двух атомов углерода, даже тот же пропилен:
H
|
H— C¹ = C² — C³ —H
| | |
H H H
Третий атом углерода будет находиться в состоянии sp³ гибридизации, как у алканов. Такой коварный вопрос может встретиться на экзамене.
Номенклатура алкенов
Алкены имеют общую формулу строения:
CₙH₂ₙ
где:
С – атом углерода
H – атом водорода
n≥2
Гомологический ряд алкенов расположился в таблице ниже.
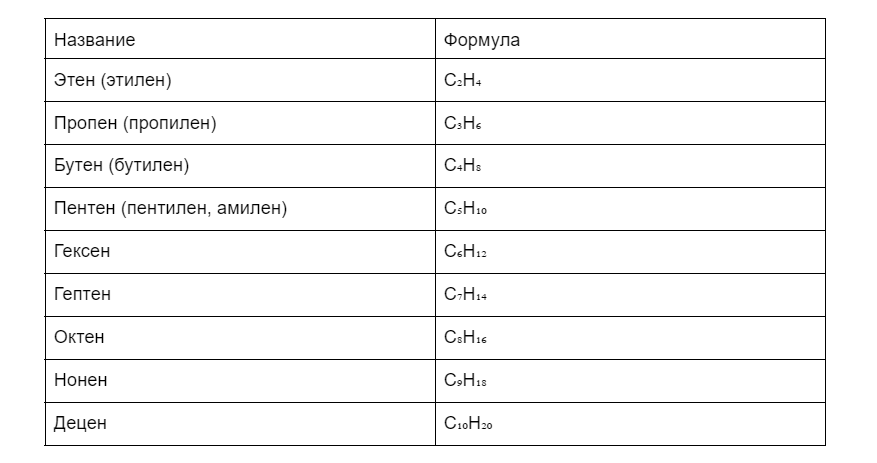
Как видно из таблицы все гомологи имеют общее окончание -ен. В остальном названия такие же, как у алканов.
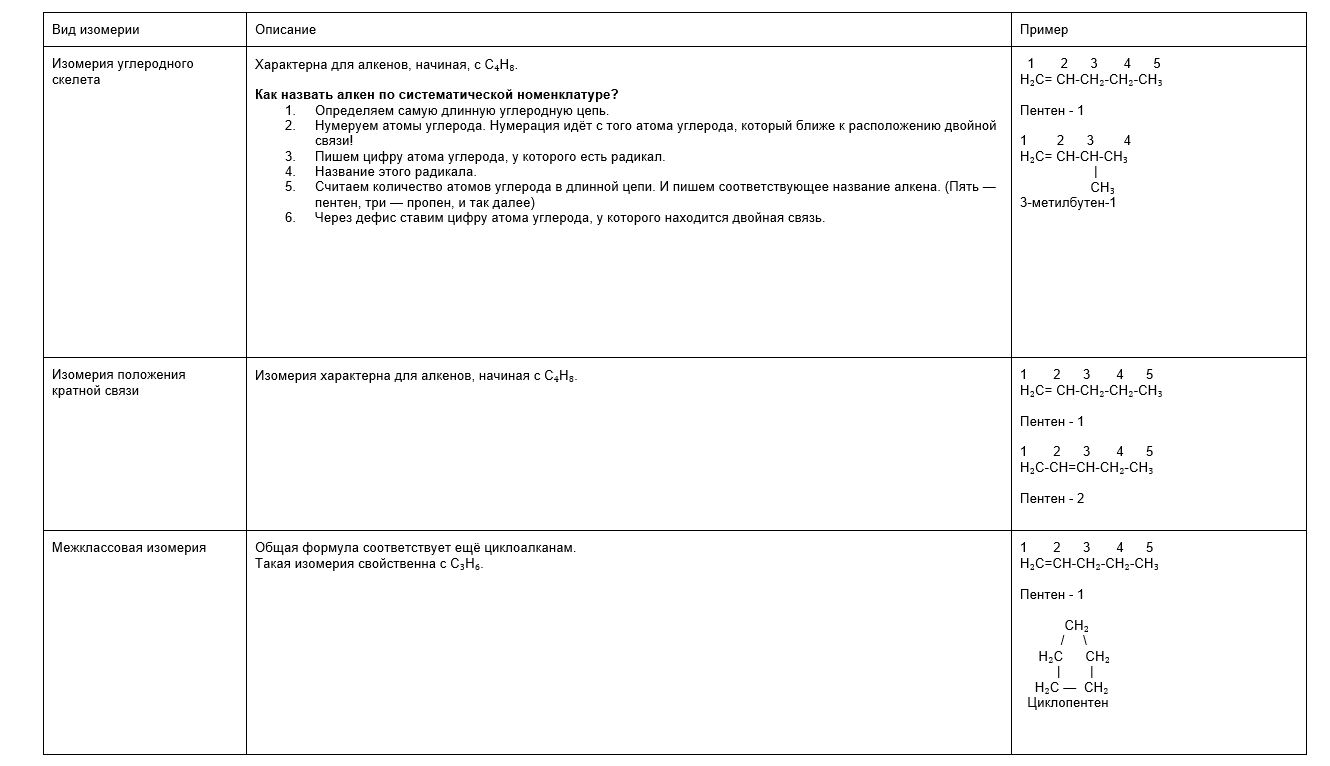
Изомерия
Чтобы было удобно изучать виды изомерии, собрали их в таблице:

Физические свойства алкенов
Физические свойства алкенов зависят от количества атомов в цепи.
C₂H₄ – C₄H₈ — бесцветные газы без запаха.
C₅H₁₀ – C₁₆H₃₂ — жидкости.
с C₁₇H₃₄ — твердые вещества.
Температура плавления в гомологическом ряду уменьшается, а температура кипения увеличивается.
Например: у C₂H₄ t (плав.) =169,2°C, t (кип.) = -109,8°C.
А у C₁₀H₂₀ t (плав.) = -66,3°C, t (кип.) = +170,6°C.
Химические свойства алкенов
Для удобства тоже собрали в таблице:

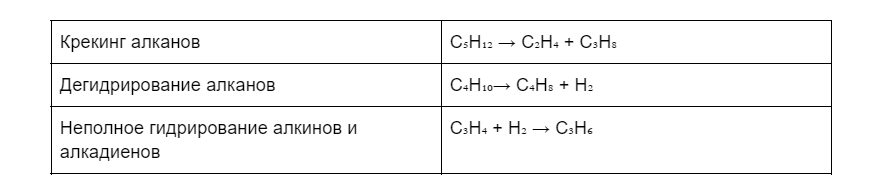
Получение алкенов в промышленности
В промышленности алкены получают несколькими методами, в основном на помощь приходят алканы:
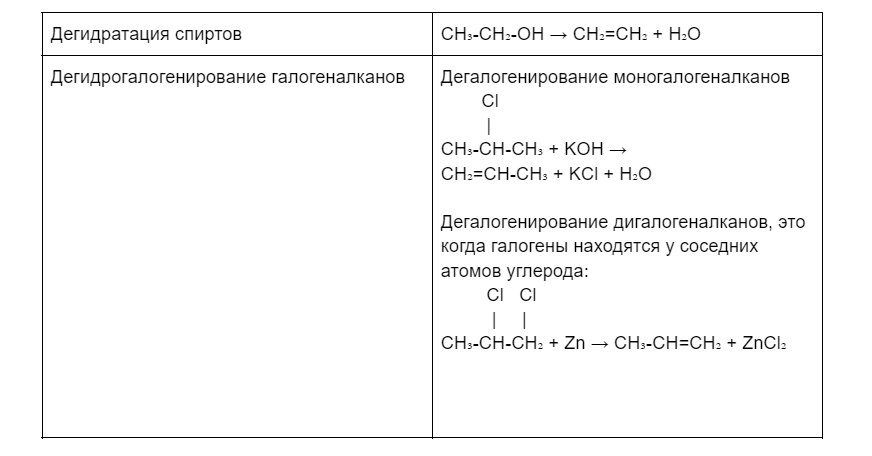
Получение алкенов в лаборатории
Но если вдруг срочно понадобится алкен, а в распоряжении только высокотехнологичная лаборатория, можно выбрать что-то из этого:
Применение алкенов
Алкены используются в промышленности полимеров: синтетических волокон, пластмасс, каучука. Например, за полиэтиленовые пакеты нужно сказать спасибо этилену. Также из него производят трубы, посуду. А еще у него есть интересное свойство: он является природным фитогормоном. И его используют для дозревания неспелых овощей, например бананов.
Проверь себя
Какая будет правильную формула алкена, если известно, что у него 50 атомов водорода?
- C₂₀H₅₀
- C₂₅H₅₀
- C₁₈H₅₀
Какой тип гибридизации характерен для этилена?
- sp
- sp³
- sp²
Какое агрегатное состояние будет у C₁₀H₂₀?
- твердое вещество
- газ
- жидкость