Строение атома
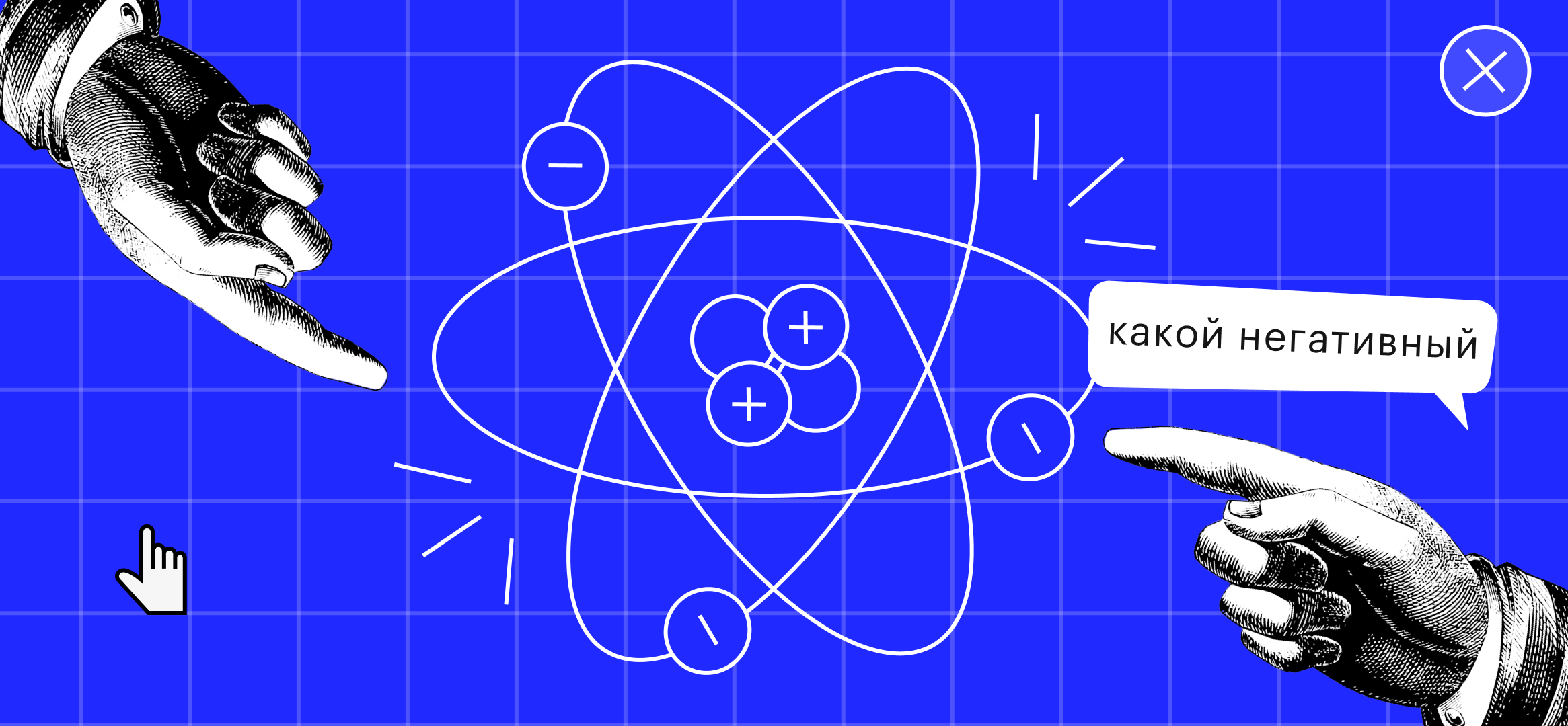
Строение электронной оболочки
Прежде чем говорить об оболочках, обратимся к истории и вспомним, что слово атом имеет греческие корни и в переводе означает «неделимый». Да-да, еще со времен Древней Греции люди предполагали, что все вокруг состоит из мельчайших частиц. Но к финальным доказательствам этой теории удалось прийти только в начале 20 века. Тогда ученые смогли показать строение атома и предложили «планетарную» модель.
Согласись, возникает ассоциация с космосом, когда смотришь на атом. Будто вокруг какой-то планеты по орбитам двигаются спутники. Вот и ученые так решили. Но из чего состоит эта «планета» и что за отрицательные спутники вокруг нее летают?
Итак, наша крошечная частица состоит из ядра и электронных оболочек. Внутри ядра размещаются элементарные частицы: протоны (положительно заряженные «+») и нейтроны (нейтральные). Электронные оболочки состоят из отрицательно заряженных элементарных частиц — электронов («-»), которые непрерывно двигаются вокруг ядра.
Строение электронных оболочек атомов элементов включает орбитали — то есть пространства, где наиболее вероятно могут располагаться электроны. Они имеют уровни, которые обозначают цифрами (1, 2, 3, 4,..) и подуровни, которые различаются по форме.
Есть 4 вида подуровней, которые отличаются формой орбиталей: s, p, d, f.
s — 1 обиталь, p — 3 орбитали, d — 5 орбиталей, f — 7 орбиталей.
Электроны имеют некую энергию, которую химики описывают четырьмя квантовыми числами:
- главное квантовое целое число n показывает энергию электронов на энергетическом уровне;
- орбитальное число l описывает тип орбитали;
- квантовое число m описывает направление орбитали;
- спиновое квантовое число s учитывает собственное движение электрона (значения: +½ и -½).
И вот как раз орбитали, которые имеют одинаковое значение n, располагаются на одной электронной оболочке.
Электроны заполняют энергетические уровни по принципу минимальной энергии: то есть сначала заполняются ближайшие к ядру низкие уровни и подуровни и далее по возрастающей (начиная с 1s орбитали и далее).

Интересный факт: количество протонов p+ в ядре химического элемента численно совпадает с зарядом ядра (Z) и порядковым номером в таблице Д.И. Менделеева. А в нейтральном атоме количество протонов = количеству электронов e-. Например: 12-й химический элемент таблицы Mg имеет 12 p+ и 12 e-.
Электронные конфигурации атомов
Итак, мы уже поняли, что наши подвижные отрицательные частицы распределены по энергетическим уровням, называемым оболочками.
Электронная конфигурация — это по сути формула, которая описывает строение электронных оболочек атомов элементов, то есть то, как расположены электроны.
Есть несколько правил, по которым определяется конфигурация:
— низшие энергетические уровни заполняются первыми;
— на орбитали может находиться не более 2 электронов с разными спиновыми квантовыми числами;
— сначала орбитали заполняются одиночными электронами с одинаковыми спинами.

Натрий имеет 11-й порядковый номер в таблице Менделеева. Считаем электроны (указаны в верхнем индексе): 2+2+6+1 = 11. И теперь смотри, как они распределяются: сначала 2 максимально возможных e- заполнили уровень 1 подуровень s, они имеют разные спиновые квантовые числа (смотри на стрелочки в графической формуле), далее 2 электрона уходят на следующий уровень 2s, на подуровне p мы имеем три орбитали, поэтому там удобно расположились 6 электронов, и оставшийся ушел одиноким на самый высокий уровень.
Характеристика элементарных частиц
А теперь немного отдохнем от формул и вернемся к самому началу. Поговорим о характеристиках составляющих атома: протонов, нейтронов и электронов.
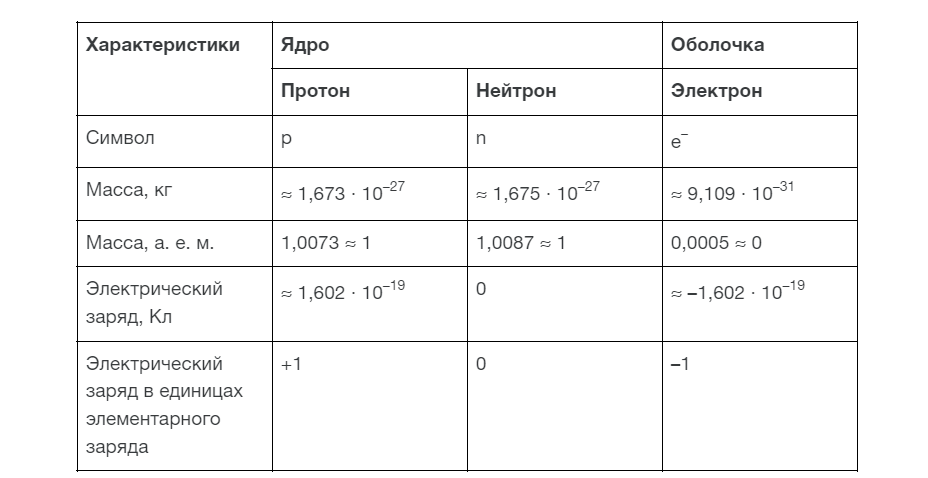
Напоминаем, протоны и нейтроны находятся в ядре и называются ядерными частицами. Протоны имеют положительный заряд, а нейтроны не имеют заряда, они нейтральны.
Электроны, как мы уже узнали, движутся вокруг ядра и имеют отрицательный заряд. Совокупность этих частиц создает уникальные химические свойства каждого элемента.
Посмотрим в таблице, какими важными характеристиками обладают наших новые друзья.
Изотопы
Довольно долго ученые считали, что масса всех атомов элемента одинакова. Но в том же начале 20 века выяснилось, что один элемент в своем составе может иметь атомы с разной массой. Ядра таких атомов содержат одинаковое количество протонов и разное количество нейтронов. Такие варианты одного элемента называются изотопами.
Например, у водорода H существует несколько изотопов: дейтерий и тритий, — у которых разное количество нейтронов в ядре.
Если в составе вещества имеются изотопы, то физические свойства таких веществ могут отличаться от тех, в которых их нет.
Помнишь, как выглядит состав воды? Элементарно: H2O.
Если в состав молекул входит протий, то такая вода закипает при 100 °С. А вот если в молекулу прокрался дейтерий D2O, температура кипения повышается до 101,42 °С.

Проверь себя
Из каких элементарных частиц состоит ядро атома?
– нейтроны и электроны;
– нейтроны и протоны;
– протоны и электроны.
Что такое изотопы?
– варианты элементов с атомами разной массы и разным количеством протонов в ядре;
– варианты элементов с атомами разных зарядов и разным количеством нейтронов в ядре;
– варианты элементов с атомами разной массы и разным количеством нейтронов в ядре.
Сколько электронов максимально может находиться на одной орбитали?
– 3;
– 5;
– 2.