Степень окисления элемента

Что такое степень окисления и как ее рассчитать?
Представь себе атом! Это маленькая частица, которая состоит из ядра и электронов. Из множества таких частиц собираются все жители таблицы Менделеева. Но нам, химикам, этого мало. Мы пробуем соединять вообще все и смотреть, как оно связывается друг с другом. И вот, в ходе одного из опытов удалось установить, что за связь в соединениях отвечают те самые электроны.
Причем тут окисление? Все просто. Так называется процесс передачи электронов от одного атома другому в результате соединения разных компонентов. И он тесно связан с другим понятием — электроотрицательностью. Так называют суперспособность наших маленьких атомов притягивать к себе валентные электроны других атомов.
К атому подошел, косарь электронов должен! Как тебе такое? Но так и выходит, что одни элементы отдают свои электроны и окисляются, а вторые принимают и восстанавливаются.
Степень окисления (СО) — это условная мера заряда атома, которая помогает нам понять, сколько электронов атом отдал или принял при образовании соединения. Это как ключ к пониманию того, как вещества связаны друг с другом.
Степени окисления элементов имеют два основных положения:
- Молекула электронейтральна, поэтому сумма степеней окисления всех компонентов в ней равна 0. Во всех простых веществах степень окисления равна 0.
- Степень окисления может быть положительной или отрицательной. Если в соединении элемент наименее электроотрицательный, он отдает электроны и испытывает их недостаток, то его СО имеет «+», а если он наиболее электроотрицательный, то принимает и имеет электроны в избытке — «-».
Мы можем рассчитать степень окисления каждого компонента, исходя из этих положений и вспомогательных данных. О них расскажем сейчас подробнее и покажем на простых примерах.
Степени окисления
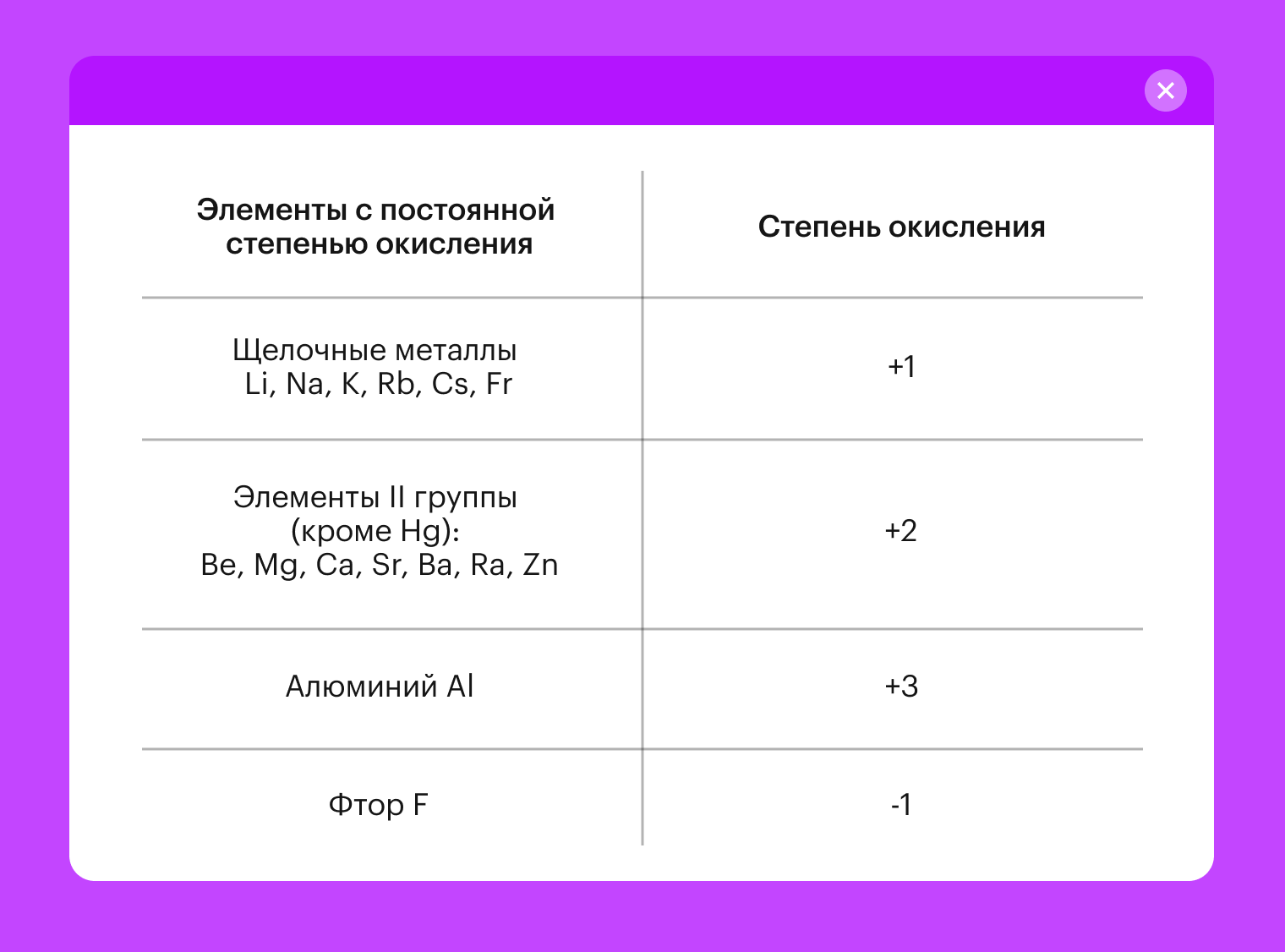
Степень окисления элемента в химическом соединении соответствует количеству электронов, которые он отдал или принял. В некоторых случаях СО — величина постоянная. Что упрощает нам вычисление степени окисления элементов соединений, которые могут иметь как низкие, так и высокие СО.
Например:
У металлов первой группы IA в соединениях постоянная степень окисления + 1.
У металлов второй группы IIA за редким исключением — степень окисления + 2.
В вот у металлов группы IIIA степень окисления всегда + 3.
Что касается самых популярных участников химических вечеринок: кислорода и водорода, — то у них СО может изменяться в зависимости от соединения.
Но мы спешим немного облегчить тебе жизнь и сообщить, что и у них есть некоторое постоянство. Чаще всего они имеют СО:
Кислород O — -2 (исключение: пероксиды и фториды кислорода).
Водород H — +1 (исключение: гидриды металлов, бора и кремния).
Для ряда элементов с переменной СО обычно указывают все возможные числа состояния этой характеристики. В разных соединениях они могут принимать одно из этих состояний в пределах высшей степени окисления (максимальный «+») и низшей степени окисления (максимальный «-»).
Для удобства мы собрали часто встречающиеся постоянные СО в таблицу.
Пример
Чтобы все эти буквы и цифры перестали быть чем-то страшным, покажем, как посчитать СО на примере:
Возьмем соединение: KNO3
Мы знаем, что у калия K — всегда +1
Это не пероксид и не фторид, значит у кислорода — -2. (так как у нас 3 молекулы, СО – -6).
И мы помним, что сумма СО в молекуле равна 0.
Примем СО азота N за х и составим просто уравнение:
+1 + х - 6 = 0
х = 6 - 1 = +5
В итоге мы получаем, что СО азота N в данном соединении равна +5: K+1N+5O-23
Возьмем пример сложнее:
NH4NO3
Здесь мы имеем два неизвестных азота. Но мы не боимся трудностей и вспоминаем, что у нас есть спасительная таблица растворимости! Ей можно пользоваться на экзаменах, так что вооружаемся и учимся ей пользоваться.
В таблице мы видим, что NH4 имеет общий заряд +. И так же просто вычисляем
х + 4 = 1
х = -3.
N-3H4
А соединение NO3 имеет общий заряд -.
х - 6 = -1
х = +5
N+5O3
Итак, определить СО нам помогают постоянная СО некоторых компонентов и таблица растворимости. И мы великолепны.
Валентность
Как и обещали, раз уж мы здесь говорим о соединениях, сложно не упомянуть о валентности.
Валентностью называют способности атомов образовывать связи. Количественно она определяется числом электронных пар, которыми один атом связан с другим.
У большинства жителей таблицы Менделеева валентность — переменная характеристика, но у некоторых это постоянная величина.

А чтобы самому не окислиться, пока готовишься к химии, записывайся на бесплатный вводный урок в Сотку. Мы рассказываем о самых сложных химических реакциях с помощью любимых мемасиков и понятных примеров. А еще с химией ты сможешь готовиться к 3 нужным предметам без доплат.
Проверь себя
Что такое степень окисления?
- когда от химии на душе невкусно и грустно;
- условная количественная мера того, сколько электронов отдает или принимает атом;
- количество электронов в одном атоме.
Какая степень окисления хлора Cl в соединении NaCl?
- -3;
- -1;
- -2.
Валентность — это…
- количество молекул в соединении;
- количество электронов, которые элемент отдает или принимает;
- количество электронных пар в соединении.