Оксиды: формулы, реакции и свойства

Введение
Строение оксида можно представить так:
ЭₓOᵧ
Где
Э, это другой химический элемент
х — количество атомов этого элемента.
О — естественно, кислород
у — количество атомов кислорода.
Для справки, фтор и инертные газы не образуют оксиды. А также вещества, где кислород имеет другую степень окисления — не являются оксидами! Например: H₂O₂ (пероксид водорода) или OF₂ (фторид кислорода).
Номенклатура оксидов
Названия оксидов принято составлять, используя номенклатуру ИЮПАК.
На первом месте стоит слово «оксид», а следом название второго элемента в родительном падеже:
Na₂O — оксид натрия
Al₂O₃ — оксид алюминия
MgO — оксид магния
CaO — оксид кальция
Если химический элемент образует несколько оксидов, то в скобках нужно указать его степень окисления. Причем римскими цифрами. Вот так:
NO Оксид азота (II)
N₂O₃ Оксид азота (III)
NO₂ Оксид азота (IV)
CO Оксид углерода (II)
CO₂ Оксид углерода (IV)
Некоторые оксиды больше известны под тривиальными названиями:
CO — угарный газ
Al₂O₃ — глинозем
SiO₃ — кремнезём
CO₂ — углекислый газ
Fe₃O₄ — железная окалина

Классификация оксидов
I. Солеобразующие оксиды
Они так называются, потому что, бинго, могут образовывать соли. Выделяют три вида:
1. Основные оксиды. Проявляют основные свойства. Примеры: (Na₂O), оксид меди (CuO), оксид калия (K₂O), оксид кальция CaO, оксид железа (FeO).
2. Кислотные оксиды. Проявляют кислотные свойства. Примеры: оксид серы (SO₃). Оксид азота (IV) (NO₂), углекислый газ (CO₂), оксид фосфора (P₂O₅), Оксид хрома (VI) и оксид марганца (VII) Mn₂O₇
3. Амфотерные оксиды проявляют и кислотные, и основные свойства. Примеры: оксид цинка (ZnO), оксид алюминия (Al₂O₃), оксид бериллия (BeO).
II. Несолеобразующие
Это те оксиды, которые при обычных условиях не образуют солей. То есть не реагируют с основаниями и кислотами. Примеры: оксид азота (I) N₂O, оксид азота (II) NO, оксид кремния(II) SiO, угарный газ или оксид углерода(II) (CO).
Как определить вид оксида?
Небольшой лайфхак:
1. Видим перед собой на формулу.
2. Понимаем, что это оксид.
3. Вглядываемся в элемент, который стоит рядом с кислородом. Металл или неметалл, вот в чем вопрос. А ещё сразу определяем степень окисления.
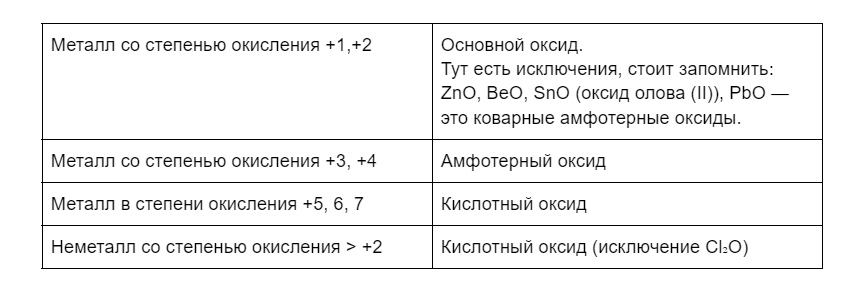
Несолеобразующие оксиды просто запоминаем. Их всего четыре: SiO, NO, N₂O, CO.
Химические свойства оксидов
Для удобства мы собрали разные свойства оксидов в таблицах:



Способы получения оксидов:
1) Взаимодействие кислорода с простыми веществами.
Кислород + неметалл:
- 2H₂ + O₂ = 2H₂O (t°)
- S + O₂ = SO₂ (сернистый газ, оксид серы (IV)) (t°) реакция сопровождается синим свечением.
- 4P + 5O₂ = 2P₂O₅ ( оксид фосфора) выделяется в виде клубов белого дыма. (t°)
- C + O₂ (избыток) = CO₂ (t°)
- 2C +O₂(недостаток) = 2CO (угарный газ, ядовит!) (t°)
- N₂+O₂= 2NO Реакция идёт при температуре около 3000°C или электрическом разряде.
- Si +O₂=SiO₂ (кремнезём)
Кислород + металл:
- 2Mg + O₂= 2MgO (t°)
- 4Al +3O₂ =2Al₂O₃ (t°)
- 2Cu + O₂ = 2CuO (t°)
2) Реакции горения сложных веществ.
Есть правило, сколько входит элементов в сложное вещество, столько и образуется оксидов:
AB + O₂ = АO + BO
Рассмотрим на примерах:
(t°)
2H₂S + 3O₂ = 2SO₂ + 2H₂O
2C₂H₆(этан) + 7O₂ = 4CO₂ + 6H₂O
SiH4(силан) + 2O₂ = SiO₂ + 2H₂O
2PH₃ + 4O₂ = P₂O₅ + 3H₂O
Во всех случаях в ходе реакции образуется два оксида. А если в сложном веществе три элемента, то получится три оксида:
4CuFeS₂ (халькопирит) + 13O₂ = 4CuO +2Fe₂O₃ + 8SO₂ (оксид серы (IV)
3) Разложение нерастворимых оснований.
Для реакции подходят также и малорастворимые основания. А чтобы это определить нужно воспользоваться таблицей растворимости.
2Al(OH)₃ (гидроксид алюминия) = Al₂O₃ + 3H₂O (t°)
Fe(OH)₂ = (t°)FeO (оксид железа (II)) +H₂O
2 Fe(OH)₃ = FeO₃ (оксид железа (III) +3H₂O (t°)
Стоит запомнить! Валентность в полученном оксиде такая же, как и в гидроксиде.
4) Разложение кислот при нагревании:
H₂SiO₃ = SiO₂ (оксид кремния (IV)) +H₂O (t°)
5) Разложение солей при нагревании:
CaCO₃ = CaO +CO₂ (t°)
MgSO₃ = MgO + SO₂ (оксид серы (IV)) (t°)
Проверь себя
NO к какому виду оксидов относится?
- Амфотерные
- Основные
- Несолеобразующие
H₂O — это какой оксид?
- Основной
- Амфотерный
- Кислотный
При взаимодействии оксида серы и оксиды алюминия, что образуется?
- Соль
- Кислота
- Основание