Кремний

Введение
Из химических элементов кремний находится на втором месте по распространенности на нашей планете. Земная кора где-то на 27,6 -29,5% состоит из кремния. Он есть в оконных стеклах, керамических кружках. И даже содержится в наших волосах, зубах и костях. Наверно, проще сказать где кремния нет, но увы статья не об этом. Кремний обозначается химическим символом Si, это сокращение от латинского названия silicium, что в переводе означает «кремень». А вот название «кремний» было предложено химиком Г. Гессом в 1834, оно имеет греческое происхождение и переводится, как «скала». Зато сразу из названия понятно, где много этого химического элемента.

Кремний. Общие сведения
Искать кремний (Si) в таблице Д.И. Менделева следует по такому адресу: IV группа, главная подгруппа, 3-й период, в ячейке под №14. Он является неметаллом.
Заряд ядра +14. А 14 электронов с удобствами расположились на трех энергетических уровнях.
Электронная конфигурация будет следующая: 1s22s22p63s23p2
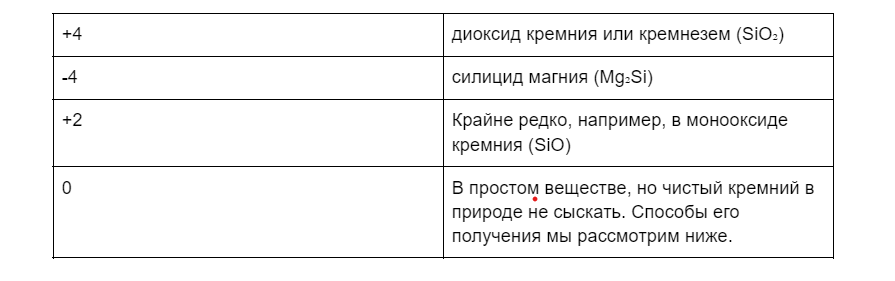
Видим, что не спарено всего 2 электрона на p-орбитали , выходит, что низшая валентность у кремния II.
Но это ещё не всё.
В возбужденном энергетическом состоянии один электрон с s-орбитали перепрыгивает на p-орбиталь. Вуаля. Неспаренных электронов аж 4 штуки. Электронная конфигурация изменяется, и будет выглядеть так: 1s22s22p63s13p3.
В итоге высшая валентность кремния равна IV.
А вот степени окисления этот элемент проявляется следующие:
Физические свойства
В природе кремний встречается только в виде соединений. В чистом виде его можно добыть только в условиях лаборатории или на предприятиях.
Кремний получают в виде кристаллов.
В природе кремний встречается только в виде соединений. В чистом виде его можно добыть только в условиях лаборатории или на предприятиях.
Кремний получают в виде кристаллов.
Темно-серого цвета, непрозрачный, с явным стальным блеском, твердый, но хрупкий. А если нагреть до 800° становится пластичным. По виду его можно перепутать с металлом, это из-за полупроводниковых свойств. Он хорошо проводит электрический ток, причем это свойство увеличивается при освещении и повышении температуры. Кремний имеет кристаллическую решётку подобную алмазу, то есть атомную. Атомы кремния связаны друг с другом четырьмя ковалентными связями. Температура плавления 1410° C.
Также получают аморфный кремний в виде бурого гигроскопичного порошка. Он используется для производства солнечных батарей и тонкопленочных транзисторов в ЖК-дисплеях.
Самое распространенное соединение кремния – это диоксид кремния (кремнезем). Который бывает аморфным (речной, кварцевый песок) и кристаллическим (кварц и его разновидности, например, горный хрусталь, халцедон, яшма, аметист, авантюрин, цитрин, агат). Да! Это всё кремнезем.
Также кремний содержится в силикатах (асбест, тальк), полевом шпате, алюмосиликатах (каолине, слюда, нефелин). На картинках ниже можно увидеть некоторых из них.

Химические свойства кремния
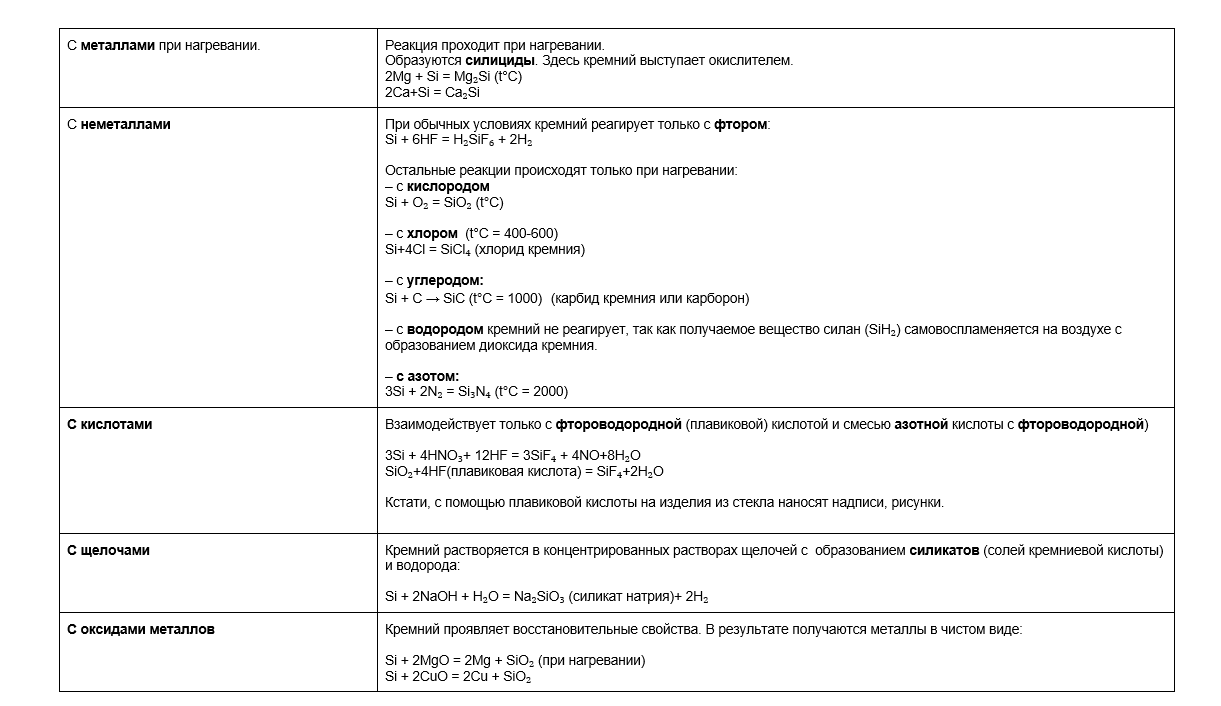
В реакциях кремний проявляет восстановительные и слабоокислительные свойства.
Способы получение кремния
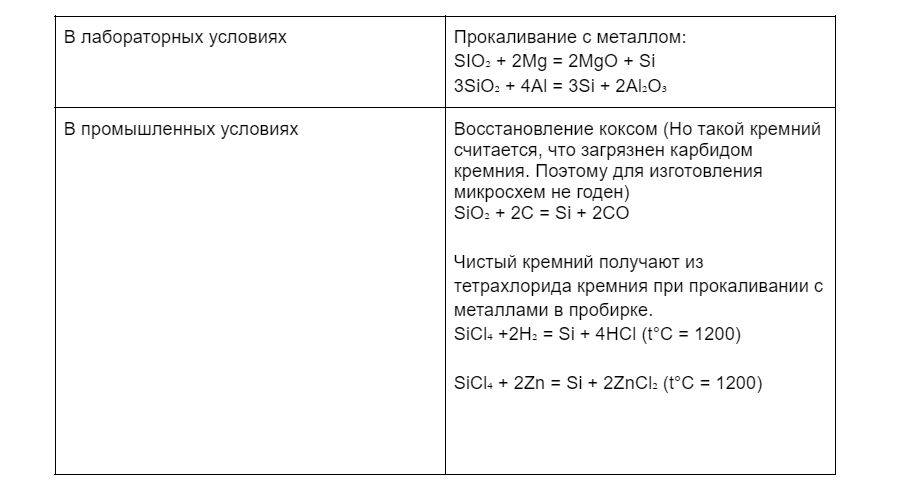
Чаще всего кремний получают из кремнезема. Но стоит отметить, что SiO₂ в обычных условиях практически ни с кем не хочет взаимодействовать, а в воде не растворяется. Оно конечно хорошо, ведь если бы кремнезем растворяется, то никаких песчаных пляжей не было. Зато диоксид кремния вступает в реакцию при сплавлении, кипячении с концентрированными растворами или при прокаливании.
А так добывают чистый кремний в лабораторных и промышленных условиях:
Применение кремния и его соединений
Где кремний только не используется. Попробуем разобраться:
- Силумин — сплав кремния и алюминия. Используется для изготовления бытовой техники, например, мясорубок, деталей для самолётов, автомобилей, катеров. А ещё из него могут сделать замки и ключи.
- Силикатный клей, он же канцелярский клей или «жидкое стекло». Тоже содержит крмений, чаще это силикаты натрия или силикаты калия: Na₂O(SiO₂)n, K₂O(SiO₂)n.
- Кремний и его соединения используются при изготовлении стекла, керамики. фарфора.
- Кремнезем в виде кварцевого песка применяется для изготовления обычного и кварцевого стёкла, цемента, фарфора, керамики. Даже ювелирных изделий.
- Ещё диоксид кремния используется в качестве антислеживающего компонента в пищевой промышленности, при изготовлении зубных паст.. В косметических средствах применяется, как эмульгатор. В медицине высокодисперсный SiO₂ входит в состав энтеросорбента Полисорба МП. Этот препарат связывает вредные вещества различного происхождения (токсины, пищевые аллергены, яды и т.д.) и выводит из организма.
- Монокристаллы кремния входят в солнечные батареи используются при изготовлении микроэлектроники.
- При высыхании кремниевых кислот образуется силикагель — высокопористое вещество, являющееся эффективным адсорбентом. Его используют как поглотитель газов, паров воды, для очистки воды, растворов, масел от различных примесей
- В цементе содержатся силикаты кальция и алюминия. Именно из-за них этот порошок при смешивании с водой затвердевает.
Проверь себя
Какая валентность у кремния?
- II
- IV
- II и IV
Какая степень окисления у кремния в Mg₂Si
- -2
- +4
- -4
С каким элементом кремний взаимодействует при обычной температуре?
- С фтором
- С азотом
- С кислородом