Гидролиз

Определение гидролиза
Представим, что в любимом сериале между лучшими друзьями произошла ссора и они разошлись по разным углам. В химии вместо персонажей у нас молекулы, а «ссорой» может стать вода, которая заставит крепкое соединение вещества разделиться.
Гидролиз — это химический процесс, при котором вещество взаимодействует с водой, и в результате происходит распад этого вещества на более простые компоненты.
Рассмотрим на примере хлорида аммония (NH4Cl). Молекулярное уравнение гидролиза хлорида аммония:
NH4Cl + H2O → NH4OH + HCl
Итак, компоненты нашего хлорида аммония «ссорятся» и мы получаем новые:
NH4OH — гидроксид аммония;
HCl — соляная кислота.
Гидролиз объясняет процесс образования многих веществ, которые мы используем каждый день. Например, как растворяется в воде соль, когда мы готовим или как происходит процесс окрашивания. Даже процесс переваривания пищи в организме тоже связан с гидролизом.
Условия гидролиза
У некоторых соединений «дружба» такая крепкая, что никакая вода не способна их разлучить. Для того чтобы гидролиз произошел, нужны определенные условия.
Рассмотрим, что требуется для реакции на примере нашей уже знакомой соли — хлорида аммония (NH4Cl). Она, как и другие соли, содержит основание — гидроксид аммония NH4OH (катион металла) и соляной кислоты HCl (анион кислотного остатка).
Эти элементы вещества могут быть сильными и слабыми. И вот тут и начинается битва, в которой победит сильнейший.
Конечно, это шутка и драться наши молекулы не будут, но гидролиз действительно зависит от силы компонентов. Посмотрим, как именно.
Важно: гидролиз происходит только в том случае, если в составе соли есть слабый ион (катион и/или анион). То есть распадаться будет слабый компонент.
В составе хлорида аммония NH4Cl есть слабое основание и сильная кислота, значит, при гидролизе распадаться будет именно гидроксид аммония NH4OH.
Индикаторы среды раствора
От того, какой компонент распадается, зависит результат реакции. В итоге может получиться кислая, щелочная или нейтральная среда раствора.
Во время гидролиза изменяется pH раствора — мера кислотности или щелочности. Он показывает концентрацию ионов водорода в растворе. Значение pH варьируется от 0 до 14:
- pH = 7 — это нейтральная среда (например, чистая вода);
- pH < 7 — кислая среда (например, лимонный сок), чем меньше значение, тем более кислая среда.
- pH > 7 — щелочная среда (например, мыло), чем больше значение, тем более щелочная среда.
Проще говоря, pH — это шкала среды раствора: кислая среда будет иметь более низкий pH, а щелочная — более высокий.
Для измерения pH используются индикаторы — вещества, меняющие свой цвет в зависимости от кислотности среды. Например, лакмусовая бумажка или фенолфталеин — популярные индикаторы, которые можно использовать даже на уроках химии, чтобы узнать, изменился ли pH раствора.
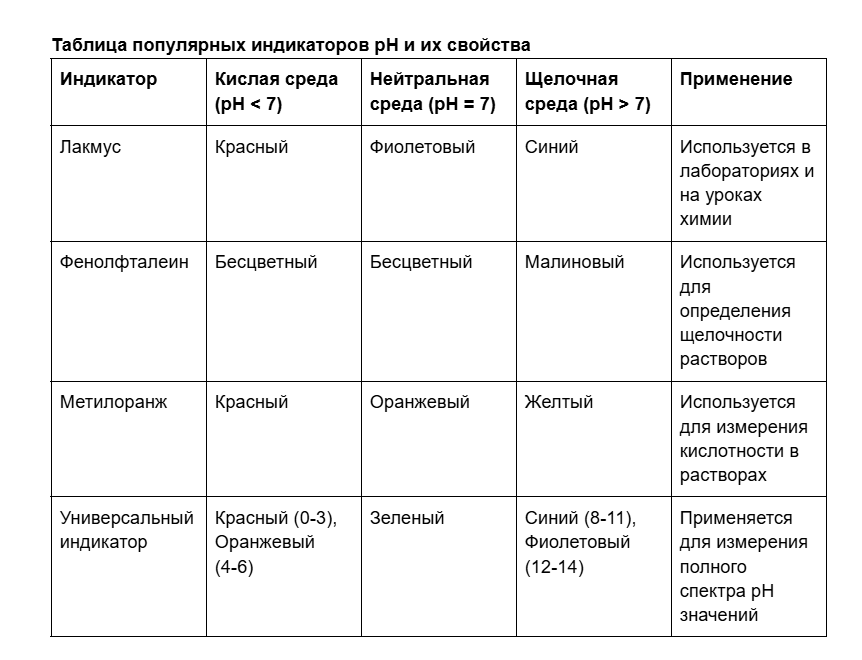
Эти индикаторы помогают быстро и легко определить, какая среда у раствора, изменяя цвет при изменении pH. Например, капнув немного фенолфталеина в раствор, можно увидеть, стал ли он щелочным: в этом случае индикатор станет малиновым.
Виды гидролиза
Теперь, когда мы понимаем, что соли могут содержать слабые ионы, которые вызывают гидролиз, разберем, какие виды гидролиза бывают. Все зависит от того, где находится слабый ион: в кислотном остатке, в основании или в обоих компонентах.
Отсутствие гидролиза
А что будет, если в составе соединения встречаются силачи? То есть мы имеем сильное основание и сильную кислоту?. Все просто: катионы и анионы не вступают в реакцию с водой, и такая соль не подвергается гидролизу. Например, сульфат натрия (Na2SO4) с сильным основанием и сильной кислотой не подвергается гидролизу. Среда нейтральна.
Гидролиз по катиону
Когда в составе соли есть слабое основание, он вступает в реакцию с гидроксид-ионами воды (OH−), образуя раствор с избытком ионов водорода (H+). Здесь происходит гидролиз по катиону.
Как мы уже выяснили, NH4Cl имеет слабое основание и сильную кислоту, значит, при гидролиз будет происходить по катиону.
Среда кислая.
Пример реакции:
NH4Cl + H2O → NH4OH + HCl
Ионное уравнение:
NH4+ + HOН → NH4OH + Н+
Гидролиз по аниону
Слабый кислотный остаток взаимодействует с ионами водорода (H+) из воды, образуя раствор с избытком гидроксид-ионов (OH−). В этом случае гидролиз происходит по аниону.
Примером может служить фторид натрия (NaF), который состоит из сильного основания NaOH и слабого кислотного остатка HF.
Среда щелочная.
Пример реакции:
NaF + H2O ↔ HF + NaOH
Ионное уравнение: Na+ + F− + HOН ↔ HF + Na+ OH−
Гидролиз по катиону и аниону
Если соль содержит только слабые элементы, то при взаимодействии с водой гидролиз затрагивает оба.
Примером служит сульфид аммония (NH4)2S, где и слабое основание NH4OH, и слабая кислота H2S участвуют в реакции гидролиза одновременно.
Гидролиз по катиону (ионное уравнение)
NH4 + +H2O = NH3*H2O + H+
Гидролиз по аниону (ионное уравнение)
S2- + H2O = HS- + OH-
Суммарное ионное уравнение гидролиза:
NH4 + +S2- + 2H2O = NH3*H2O + HS- + H+ + OH-
Молекулярное уравнение:
(NH4)2S + 2H2O = NH3*H2O + NH4HS + H2O
Знания о том, как разные вещества взаимодействуют с водой, помогут решать задачи ЕГЭ и ОГЭ на определения кислотности, состава растворов и даже предсказывать поведение некоторых химических соединений. Представь, как можно впечатлить всех вокруг своими знаниями, когда знаешь, что простая вода способна на настоящую химическую магию.
Проверь себя
Что такое гидролиз?
– процесс соединения молекул водорода с другими молекулами;
– процесс взаимодействия вещества с водой, приводящий к его распаду на более простые компоненты;
– процесс нагревания воды до высокой температуры.
Какое условие необходимы для того, чтобы произошел гидролиз?
– наличие слабого иона;
– наличие солнечного света;
– только наличие воды.
Если в соединении слабое основание, то гидролиз проходит
– по катиону;
– по аниону;
– по катиону и по аниону.