Галогены
Введение
В химии галогены это элементы 7 группы, главной подгруппы таблицы Д. И. Менделеева, или 17-й группы по новой классификации.
Название переводится как «солероды», «солерождающие». Уже из этого можно понять, что это очень химически активные вещества, образующие много солей.
Также недавно открытый химический элемент N117 Ts (Теннессин) тоже находится в 17 группе, но его свойства пока до конца не изучены. Известно только, что он крайне радиоактивен.
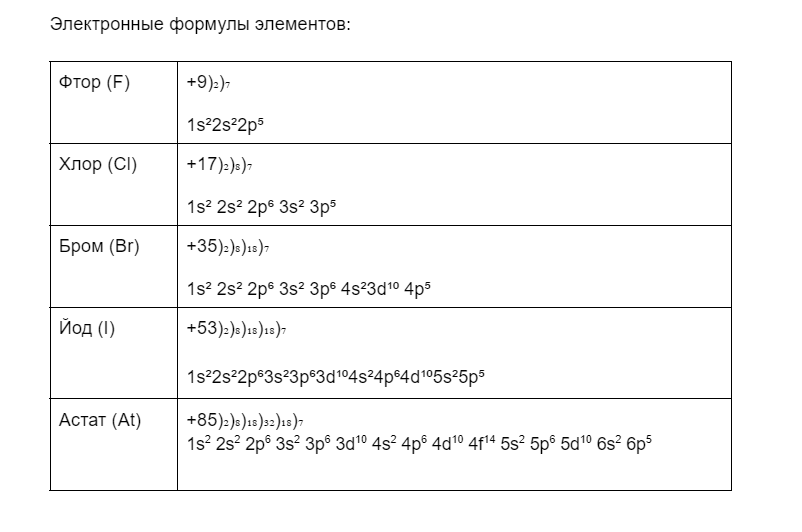
Все галогены — неметаллы. На внешней орбитали у всех элементов имеется семь электронов. Чтобы полностью забить электронами внешний уровень не хватает одного электрона.
Кроме фтора у остальных галогенов есть запасной d подуровень, на котором может расположиться распаренный электрон. Поэтому у фтора валентность всегда I.
А вот у хлора, брома, йода может быть: I, III, V, VII.

Физические свойства галогенов
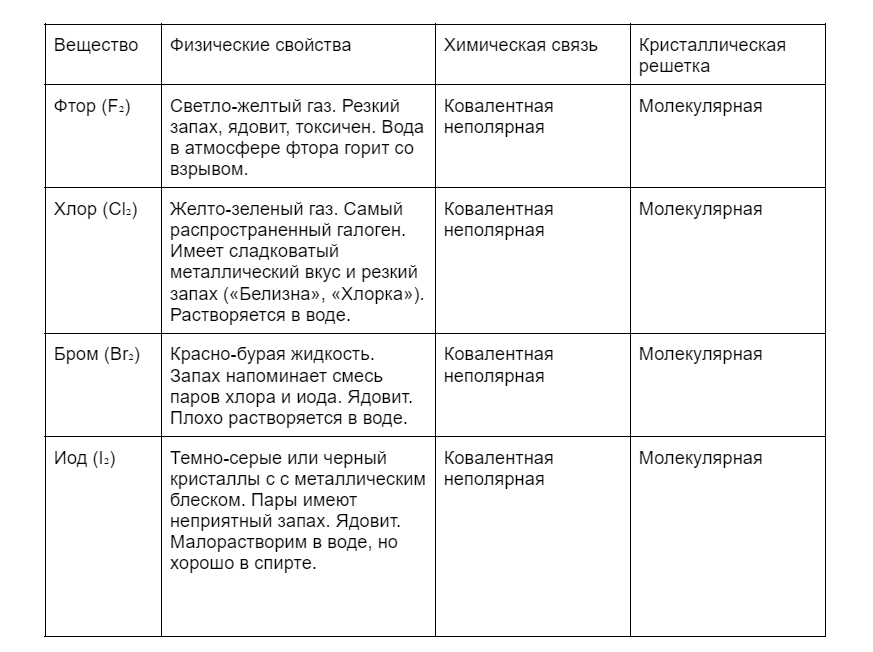
Все галогены образуют простые вещества.
Сверху вниз в таблице будут уменьшаться неметаллические свойства и увеличиваться металлические.
В природе галогены встречаются чаще в составе сложных веществ, например, CaF₂ (плавиковый шпат), NaCl (галит), KCl (сильвин), MgCl₂ (бишофит).
Химические свойства галогенов
Фтор наиболее активный галоген. Он вступает даже в те химические реакции, в которые не может иод. Рассмотрим некоторые химические свойства.


Интересна реакция взаимодействия хлора с угарным газом. На выходе образуется фосген — боевое отравляющее вещество!
Cl₂ + CO = COCl₂ (фосген)
Способы получения галогенов
В лаборатории и на промышленности галогены получают разными способами. Попробуем разобраться.
В лабораторных условиях
а) Фтор (F₂) в лаборатории не получают. Он очень активен и быстро вступает в реакции.
b) Хлор (Cl₂) в ходе взаимодействия соляной кислоты с окислителем (MnO₂ (оксид марганца), KClO₃ (бертолетова соль или хлорат калия), KMnO₄ (перманганат калия), K₂Cr₂O₇ (дихромат калия))
4HCl + MnO₂ = MnCl₂ + Cl₂ + 2H₂O
16HCl + 2KMnO₄ = MnCl₂ +2KCl + 5Cl2 + 8H₂O
c) Br₂ получают из бромидов:
2KBr + MnO₂ + 2H₂SO₄ = MnSO₄ + K₂SO₄ + Br₂ + 2H₂O
d) I₂ получают аналогично из иодидов:
2KI + MnO₂ + 2H₂SO₄ = MnSO₄ +K₂SO₄ + I₂ +2H₂O
В промышленности
Фтор получают только электролизом расплавов солей.
CaF₂ = Ca + F₂
Хлор получают путем электролиза растворов и расплавов их солей:
2NaCl + 2H₂O = H₂ + Cl₂ + 2NaOH
Бром получают путем замещения его в соли хлором:
2KBr + Cl₂ = 2KCl + Br₂
Иод добывают из нефтяных буровых вод, золы морских водорослей.
Применение
- Фтор используется в зубных пастах. Входит в состав антипригарного покрытия (тефлона). Фреон, который применяется в качестве хладагента в холодильниках, содержит в составе фтор.
- Хлор используется для очистки воды в водосточных трубах, бассейнах. Входит в состав отбеливателей, моющих средств. Знаменитая хлорка так называется не с проста. Также хлор необходим в производстве поливинилхлорида. Или сокращенно ПВХ. А из этого материала создают оконные рамы, водопроводные трубы и т.д.
- Бром используется в качестве красителя. А ещё им тушат пожары.
- Иод можно найти, наверно, в каждой аптечке. Отличное дезинфицирующее средство. Но еще иод необходим в производстве жидкокристаллических экранов.
- Астат используют в клинической радиологии для лечения рака щитовидной железы.
Проверь себя
Какой галоген более электроотрицательный?
- Иод
- Фтор
- Астат
С каким элементом взаимодействует азот?
- Фтор
- Иод
- Хлор
Сколько электронов на внешнем уровне у брома?
- 3
- 6
- 7