Фосфор

Введение
Алхимики совершили много открытий в области химии. Фосфор тоже они первым обнаружили. Кстати, он входит в состав АТФ, а это универсальный источник энергии для клетки. Чем не философский камень? Ещё он присутствует в нуклеотидах, фосфопротеидах, фосфолипидах, ферментах, костях, зубной эмали. Продолжать можно бесконечно.

Фосфор. Общие сведения
Фосфор химический элемент N15 третьего периода, V группы, главной подгруппы таблицы Д. И. Менделеева.
Заряд ядра +15.
В обычном состоянии вакантных электронов у фосфора 3. Так выглядит электронная конфигурация:
Но у фосфора есть ещё свободнее d уровень. Поэтому в возбужденном состоянии у фосфора распаривается пара электронов на 3s-уровне, и один электрон съезжает в новую комнату. Конфигурация будет следующая:
Фосфор имеет валентности III и V.
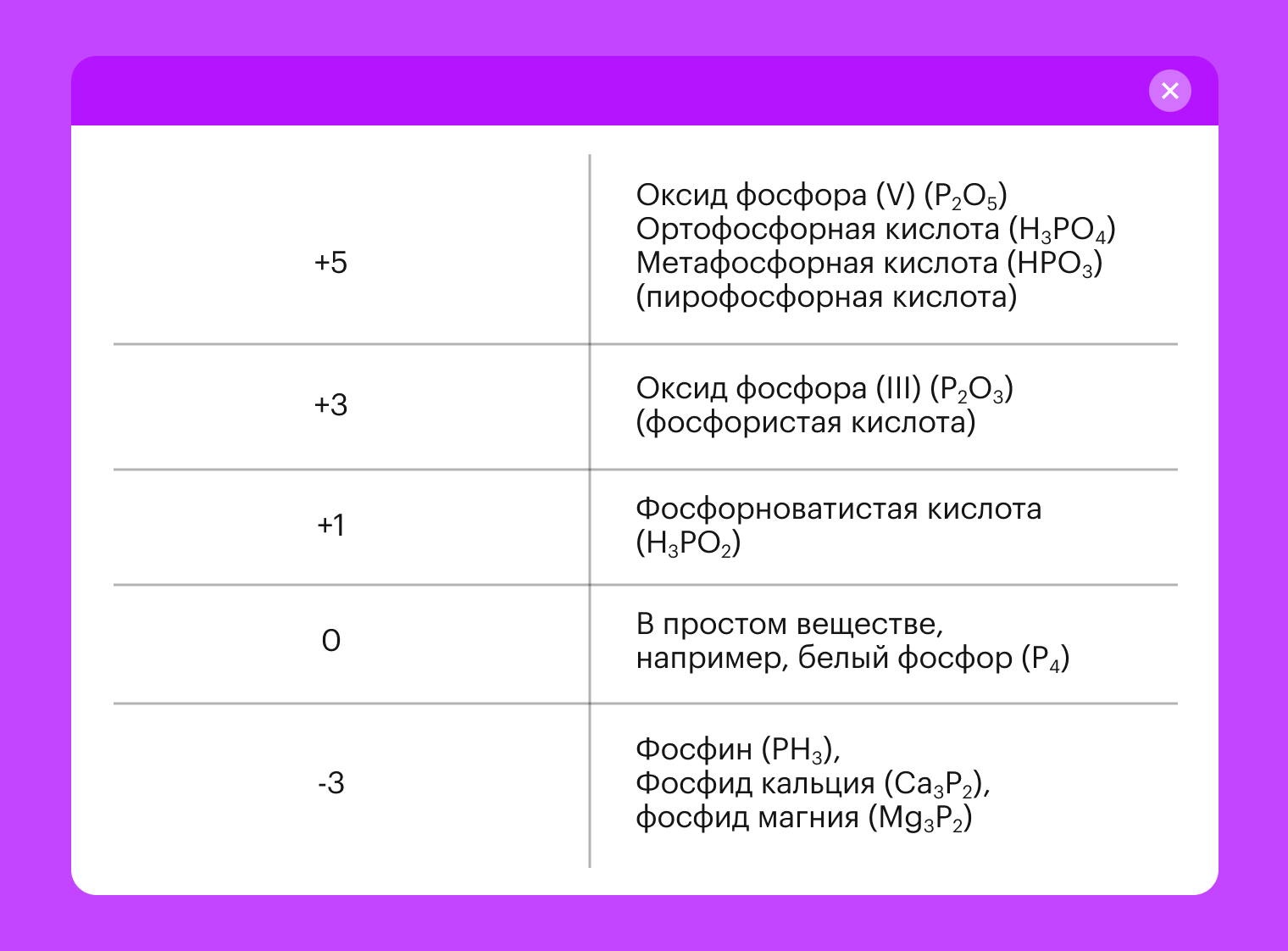
А степеней окисления может быть несколько, главное не запутаться:
Физические свойства
Фосфор в виде простого вещества представлен несколькими аллотропными модификациями. Говорят, что обнаружены ещё не все. Но мы ждать точно не будем, когда там учёные договорятся, поэтому рассмотрим основные четыре вида.

Самое главное, что нужно по ним запомнить, что от белого фосфора к металлическому снижается химическая активность.
Нарастают металлические свойства, особенно электропроводимость.
Химические свойства фосфора
Самым химически активным будет белый фосфор. Его формула будет P₄, но допустимо писать просто P без индекса.

Способы получение фосфора
В конце XVII века ученый, которого звали Х. Бранд смог получить фосфор интересным способом. Сначала он выпарил мочу, а потом, образовавшийся, осадок стал нагревать с белым песком. Быстро и эффективно.
Так конечно уже никто не делает, но если что — метод рабочий.
Основным же способом получения фосфора в промышленности является спекание фосфата кальция с керамзитом и углем. Реакция протекает при высокой температуре (t=1600 °С) и в отсутствии воздуха. Пары белого фосфора скапливаются в приемник под водой.
Ca₃(PO₄)₂ + 3SiO₂ + 5C = 3CaSiO₃ + 5CO + 2P(t°C)
Фосфор можно получить и из других соединений, как пример:
4HPO₃ (метафосфорная кислота) + 12C = 4P + 2H₂ + 12CO.
Соединения фосфора
Рассмотрим некоторые из соединений фосфора. Какие-то из них мы уже встречали пока разбирали химические свойства химического элемента N15.
Оксид фосфора (III) P₂O₃
Твердое вещество, белого цвета с неприятным запахом. Ядовит.
Растворяется в воде с образованием кислоты:
P₂O₃ + 3H₂O = 2H₃PO₃ (фосфористая кислота)
Взаимодействует с основаниями, в итоге получается фосфит (соль фосфористой кислоты) и вода:
P₂O₃ + 4KOH = 2K₂HPO₃ (фосфит калия) + H₂O
Оксид фосфора (V) P₂O₅
Внешне особо не отличается от предыдущего оксида. Белое кристаллическое вещество. Но очень гигроскопичное, то есть оксид способен впитывать в себя водяные пары из воздуха. С его помощью получают ангидриды кислот.
При взаимодействии с водой образует разные кислоты, например, метафосфорную кислоту (HPO₃) или ортофосфорную (H3PO4):
P₂O₅ + 3H₂O = 2H₃PO₄ (ортофосфорная кислота)
Взаимодействует с оксидами металлов:
P₂O₅ + 3СaO = Ca₃(PO₄)₂ (фосфат кальция)
Взаимодействует с щелочами:
P₂O₅ + 6NaOH = 2Na₃PO₄ (фосфат натрия) + 3H₂O
Реагирует с солями:
P₂O₅ +3K₂SO = 3SO₂ + 2K3PO4
Кислоты фосфора
Фосфор образует множество кислот, рассмотрим только самые популярные:
H₃PO₂ — фосфорноватистая или фосфиновая). Бесцветное кристаллическое вещество. Хорошо растворяется в воде, этаноле, эфире. Сильная кислота. Образует соли гипофосфиты.
H₂PO₃ — фосфористая (фосфоновая). Кристаллическая, бесцветная. Обладает высокой гигроскопичность. Кислота средней силы. Соли фосфиты или фосфонаты.
H₃PO₄ — ортофосфорная (фосфорная). Твердое кристаллическое вещество. Хорошо растворяется в воде и растворителях. Слабая кислота. Соли называются фосфаты или ортофосфаты. На ее примере рассмотрим некоторые химические реакции.
Кислоты взаимодействуют с металлами
2H₃PO₄ + 3Сa = Ca₃(PO₄)₂ + 3H₂
С оксидами:
2H₃PO₄ + 3CaO = Ca₃(PO₄)₂ + 3H₂O
С основаниями:
Н₃PO₄ + 3NaОН = Na₃PO₄ + 3H₂O
Фосфин (PH3)
Газ без цвета с отвратительным запахом, чем-то похожим на тухлую рыбу приправленную чесноком. Очень ядовит. Плохо растворяется в воде, но не может устоять перед органическими растворителями.
Взаимодействует с кислотами:
PH₃ + 8HNO₃ = H₃PO₄+ 8NO₂ + 4H₂O
Горит в кислороде:
2PH₃+4O₂ = P₂O₅ (с избытком) + 3H₂O
PH₃ + 2O₂ = H₃PO₄
Применение фосфора и его соединений
Без фосфора жизнь была б не та. В каких сферах только он не засветился:
1. В производстве спичек используется красный фосфор. Его на клей прикрепляют на боковую поверхность спичечного коробка. применяют в производстве спичек. Кстати, а в спичечной головке содержится сера и хлорат калия.
2. В промышленности фосфаты используются для защиты металлов от коррозии. Входят в состав средств для смягчения воды.
3. В сельском хозяйстве активно используются фосфорные удобрения: суперфосфат, аммофос (NH₄H₂PO₄), преципитат.
4. Фосфорорганические соединения (ФОСы) применяются в качетве инсектицидов (Карбофос, Диклофос). С той же целью используется фосфин, то есть для уничтожения вредителей, а ещё для фумигации зернохранилищ. Для человека эти вещества крайне токсичный.
5. На поле боя могут применяться бомбы с белым фосфором. Для освещения и создания дымовой завесы.
Проверь себя
Сколько у фосфора валентных электронов?
- 5 в обычном состоянии
- 2 в возбужденном состоянии
- 8 вроде.
Какой фосфор светится в темноте?
- Черный
- Белый
- Красный
С каким элементом фосфор не взаимодействует?
- Кальций
- Фтор
- Водород