Азот: свойства и формула

Введение
В воздухе азота 78%, намного больше чем необходимого нам кислорода. Но не стоит списывать его со счетов. Азот тоже очень ценный элемент. Он входит в состав ДНК и РНК, аминокислот, витаминов. То есть дышать мы азотом не можем, но и жить без него тоже. Забавно, что его название переводится «безжизненный».

Азот. Общие сведения
Химический символ азота «N» от латинского названия «nitrogenium».
В таблице Д. И. Менделеева он находится во 2-м периоде, V группе, главной подгруппе (по новой классификации в 15 группе). Неметалл. Так как азот первый элемент в V группе, то часто ее называют «группа азота», а ещё иногда пниктогены, это можно перевести, как «дурно пахнущие» или «удушающие».
Заряд ядра азота +7. Соответственно и электронов семь штук. Из них на внешнем уровне находится пять: два спаренных и три свободных.
Электронная конфигурация следующая: 1s22s22p³
В возбужденное состояние азот перейти не может, свободных орбиталей нет и электронам прыгать некуда.
Выходит, что по обменному механизму азот может вступить в три связи. А с помощью спаренных электронов ещё в одну по донорно-акцепторному механизму. Вместо тысячи слов, лучше посмотрим на катион аммония. Так лучше запомнится:
Как итог: валентность азота IV! Несмотря на то, что он находится в V группе. Стоит запомнить.
А со степенями окисления у азота полный трэш:

Физические свойства
Молекулярный азот (N₂) — это газ без цвета и запаха. Практически не растворяется воде.
Становится жидкостью при температуре -195,8° С.
А при температуре −209,86 °C представляет из себя белое твердое вещество, похожее на снег. Аллотропных модификаций у азота нет.
Химические свойства азота
В молекулярном азоте (N₂) между атомами азота три ковалентных неполярных связи. Очень прочное соединение, которое не так-то просто разорвать. Поэтому азот не реагирует с чем попало. Или требует нагревания.

Способы получение азота
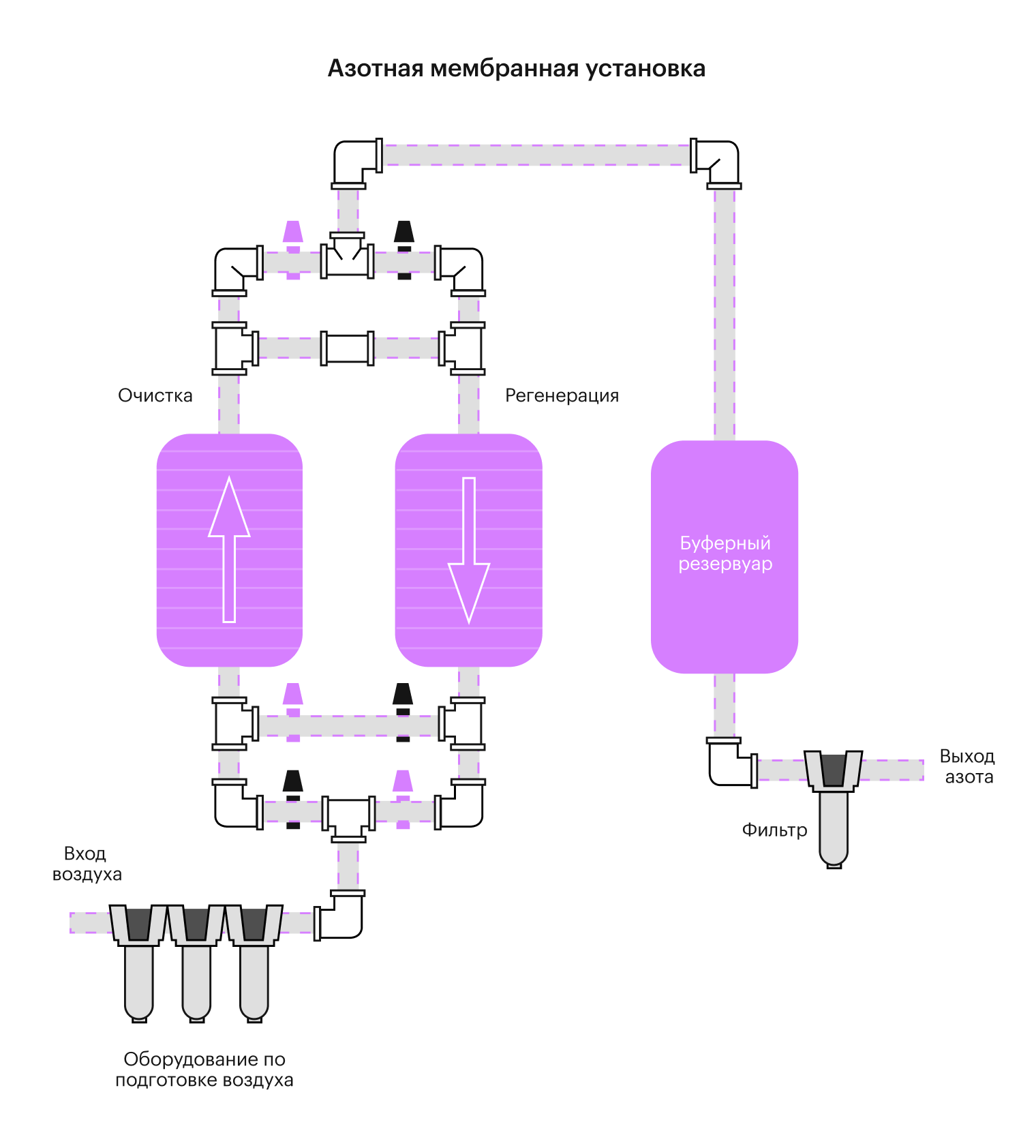
В промышленности азот получают просто из воздуха, его же там 78%. С помощью адсорбционного, мембранного или криогенного разделения воздуха.
В лабораторных условиях есть более изощренные методы получения азота.
1) Разложения солей аммония при нагревании:
(NH₄)₂Cr₂O₇ (дихромат аммония) = Cr₂O₃ + N₂ + 4H₂O (t°C)
NH₄NO₂ (нитрит аммония или аммиачная селитра) = N₂ + 2H₂O (t°C)
2) Получение азота из азида натрия при нагревании:
2NaN₃ = 2Na + 3N₂
Соединения азота
Аммиак NH₃
Газ без цвета, но с очень специфическим запахом. Ядовит. А при температуре ниже 33,4° становится жидкостью. Прекрасно растворим в воде. Водный раствор аммиака называют аммиачной водой или гидроксидом аммония. Нашатырный спирт, который есть почти в каждой аптечке, это 10% водный раствор аммиака.
Рассмотрим некоторые его химические свойства. Во всех реакциях аммиак будет восстановителем.
1. Растворяясь в воде образует гидроксид аммония (NH₄OH) — слабое основание. Которое находится в диссоциирует на гидроксид ион и катион аммония.
NH₃ +H₂O = NH₄ + + OH- (гидроксид ион)
2. С кислотами. Образуются соли аммония.
NH₃ (раствор) +HCl = NH₄Cl (хлорид аммония)
2NH₃ + H₂SO₄ = (NH₄)₂SO₄ (сульфат аммония)
3. Взаимодействие с кислородом происходит при нагревании.
Горение в чистом кислороде:
4NH₃ + 3O₂ = 2N₂ + 6H₂O (t°)
Окисление в присутствии катализатора (чаще Pt или Cr2O3):
4NH₃ + 5O₂ → 4NO + 6H₂O (кат, t°)
4. Аммиак взаимодействует с галогенами.
2NH₃ + 3Cl = 6HCl + N₂ (t°)
2NH₃ + Br₂ = N₂ + 6HBr (t°)
5. Взаимодействует при нагревании с оксидами металлов с образованием молекулярного азота.
2NH₃ + 3CuO = 3Cu +N₂ +3H₂O (t°)
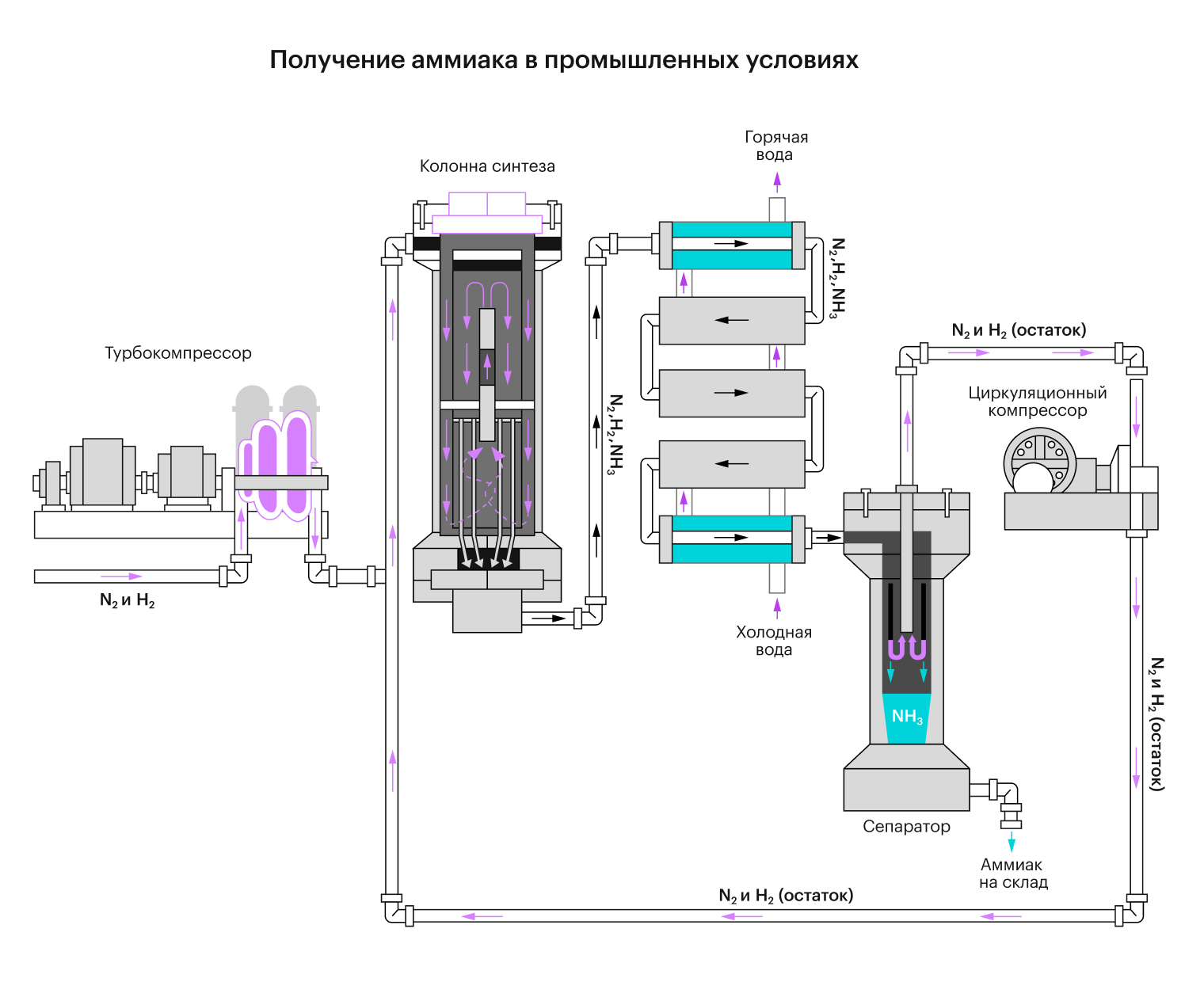
Как получить аммиак?
В промышленных условиях аммиак получают из молекулярного водорода (H₂) и азота (N₂). При условии наличия высокого давлением ≈ 35MПа, катализатора (Fe) и температуры 500°C. Реакция обратима, идёт с выделением тепла.
N₂ + 3H₂ ⇄ 2NH₃ (t, катализатор Fe, p).
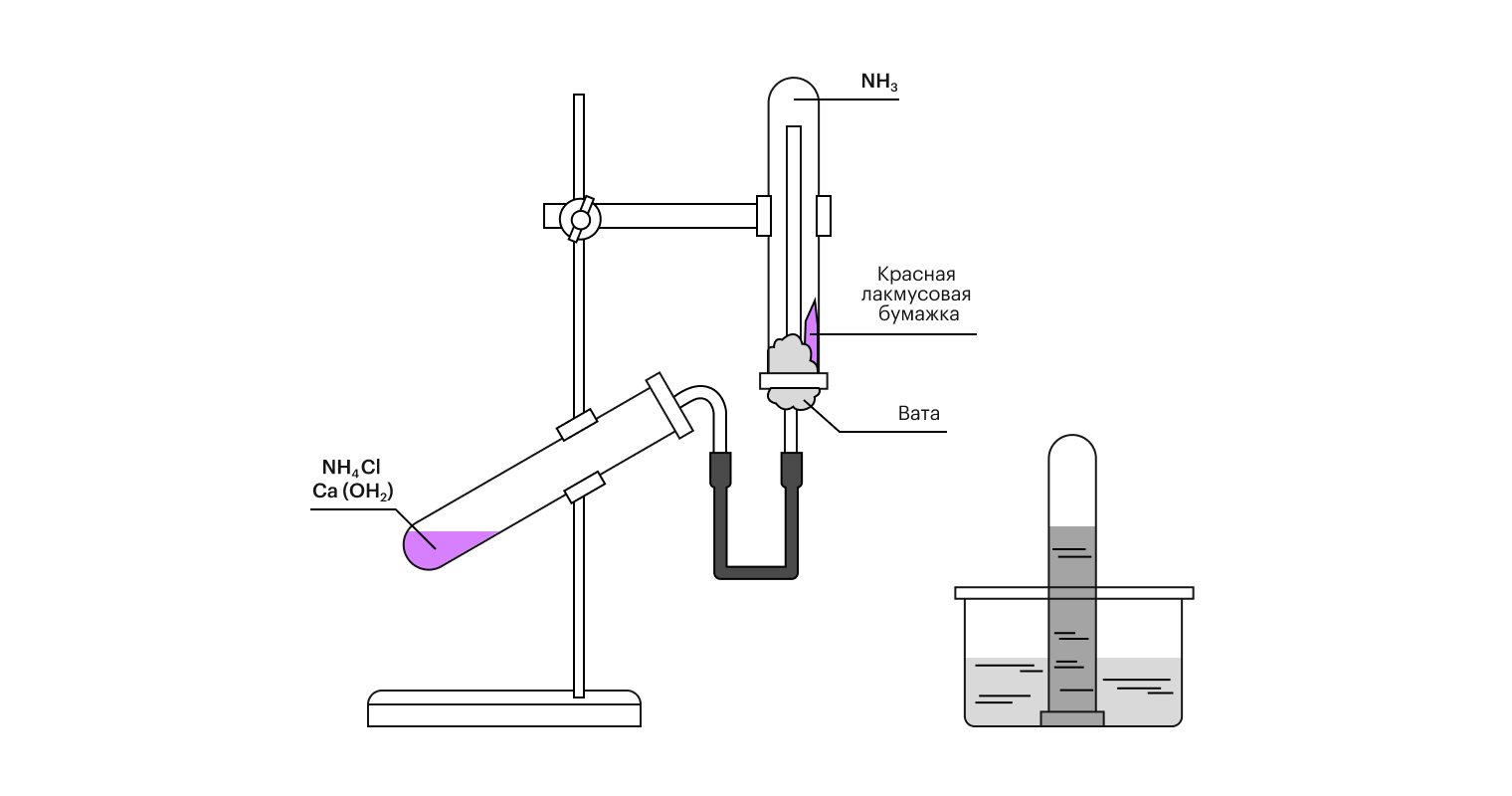
В лаборатории аммиак получают путем соединения солей аммония и сильный щелочей:
2NH₄Cl + Сa(OH)₂ = CaCl₂+ 2NH₃ + 2H₂O.
Оксиды азота
Оксид азота I (N₂O) — бесцветный газ с приятным запахом. Также называется: закись азота, «веселящий газ».
Используют в медицине для проведения масочного наркоза.
Оксид азота II (NO) — тоже газ, и тоже бесцветный. Мы уже рассматривали реакцию его получения при взаимодействии молекулярного азота и кислорода. NO на воздухе окисляется до NO₂.
Оксид азота III (N₂O₃) — темно-синяя жидкость.
N₂O₃ соответствует азотистая кислота HNO₂
Оксид азота IV (NO₂) — ядовитый газ бурого цвета, оказывает раздражающие действие на слизистую дыхательных путей и оболочки глаз.
При взаимодействии с водой образует сразу две кислоты:
H₂O + 2NO₂ = HNO₂ (азотистая кислота) + HNO3 (азотная кислота)
В присутствии кислорода, только азотную кислоту:
2H₂O + 4NO₂ + O₂ = 4HNO₃
Тетраоксид диазота (N₂O₄) —желто-коричневая летучая жидкость. При замораживании становится бесцветной. Диссоциирует до оксида азота IV при нагревании (140°C). Используется в качестве некриогенного окислителя для ракетного топлива. NO₂ и N₂O₄ существуют в смеси и имеют одинаковые химические свойства.
Оксид азота V (N₂O₅) бесцветное летучее кристаллическое вещество. Токсичен, при разложении образует ещё более ядовитый NO₂. С органическими веществами реагирует со взрывом.
N₂O₅ — соответствует азотная кислота HNO₃.
Стоит запомнить, что оксиды NO, N₂O относятся к несолеобразующим, поэтому с водой, с растворами щелочей и кислот не взаимодействуют. А N₂O₃, NO₂, N₂O₅ солеобразующие оксиды.
Азотная кислота (HNO₃)
— бесцветная жидкость, имеет противный запах. Хорошо растворяется в воде, полностью распадаясь на ионы. Концентрированная азотная кислота дымится на воздухе. Очень агрессивна и опасна, ее можно переводить только в контейнерах из стали и алюминия.
Смесь азотной кислоты с соляной кислотой 1:3 (может быть другое соотношение) называется царская водка. Она в легкую растворяет даже золото.
Азотная кислота взаимодействует практически со всеми металлами, их оксидами и гидроксидами:
4HNO₃ (концентрированная) + Cu = Cu(NO₃)₂ + 2NO₂ +2H₂O
8HNO₃ (разбавленная) + 3Cu = 3Cu(NO₃)₂ + 2NO +4H₂O
CuO + 2HNO₃ = Cu(NO₃)₂ + H₂O
Вступает в реакции обмена с солями, если выделяется газ, осадок или слабый электролит..
CaCO₃ + 2HNO₃ = Ca(NO₃)₂ + H₂O + CO₂
Применение азота и его соединений
1. Атомы в молекуле азота связаны сильнее, чем у того же кислорода. Поэтому азот химически инертен. Из-за этой его особенности он используется для создания инертной среды, там где нужно исключить окисление, коррозию или увеличить срок хранения. Например, на производстве электронных плат и полупроводников, а также для хранения продуктов питания.
2. N₂O уже 160 лет используется в анестезиологии для проведения наркоза.
3. Азотом тушат пожары в шахтах и подземных туннелях.
4. Азотные удобрения повышают урожайность, поэтому активно используются в сельском хозяйстве.
5. Азот входит в состав нитроглицерина. Этот сосудорасширяющий препарат используется в кардиологии при ишемической болезни сердца, которая может привести к инфаркту миокарда. А ещё нитроглицерин — это взрывчатое вещество, и на его основе создают динамит.
6. Тринитротолуол, более известный как тротил, тоже в составе содержит азот. Он используется для демонтажа дорог, зданий. Применяется для создания взрывчатых снарядов.
7. В фотографии в качестве цветосохраняющего средства применяют соли гидроксиламина.
8. Нашатырный спирт используется в медицине и вредит в состав моющих средств.
9. Азотная кислота применяется в производстве лаков, красок, фунгицидов, в фармакологии.
10. Жидкий азот используется для криоконсервации, глубокой заморозки органики, для охлаждения техники.
Проверь себя
Какая валентность у азота?
- I;
- V;
- IV.
Какой кислоте соответствует N₂O₅?
- Азотная кислота;
- Азотистая кислота;
- Никакой.
Как называется N₂O₄?
- Оксид азота (III);
- Тетраоксид диазота;
- Нитрид кислорода.