Алканы

Определение
Мир органической химии полон чудес. А начнем мы погружение с алканов. Они считаются наиболее простыми углеводородами.
Углеводороды – это вещества, которые в составе имеют только углерод и водород.
Причем углерод находится в возбужденном состоянии и имеет валентность IV (это во всей органике кстати, стоит запомнить). И выходит, что один атом углерода может образовать только 4 связи. Вообще связи могут быть одинарными, двойными, тройными.
Но алканами называются ациклические углеводороды, в которых атомы углерода образуют только одинарные (простые или σ-) связи.
Еще алканы называют предельными или насыщенными углеводородами — из-за того, что атом углерода достиг предела (образовал максимально допустимое количество связей). И всё, баста, больше он уже не может, насыщен по полной!
Номенклатура алканов
Есть общая формула алканов, выглядит она так:
CₙH₂ₙ₊₂
где:
С – атом углерода
H – атом водорода
n≥1
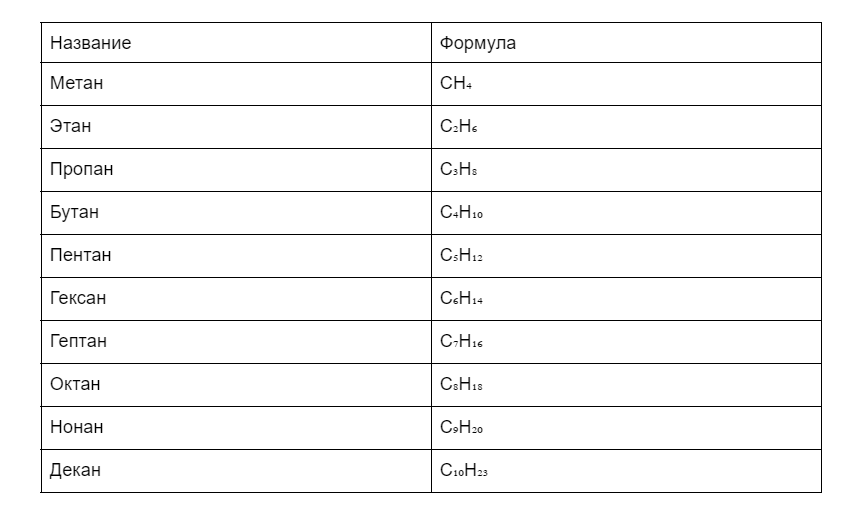
Чтобы убедиться в правильности формулы, посмотрим на первых десять представителей на картинке.
Стоит обратить внимание, что каждое название заканчивается на -ан.
Первые четыре наименования сложились исторически, а начиная с пятого образуются от греческих числительных.
Конечно, алканов больше десяти, точнее, их бесконечное множество. Например, есть такие: гексадекан (С₁₆Н₃₄), эйкозан (C₂₀H₄₂),триконтан (C₃₀H₆₂).
Если посмотреть на формулы из таблицы, можно заметить, что каждый последующий алкан от предыдущего отличается группой CH₂. Она называется гомологической единицей или гомологической разностью.
Гомологический ряд – ряд органических соединений, имеющих сходное строение, но отличающихся от соседних на постоянную структурную единицу (гомологическую разность).
Вещества, члены гомологического ряда, называются гомологами.
Для примера возьмем пропан. Его ближайшими гомологами будет этан и бутан. Но и все другие алканы, даже трикотан, будут для пропана гомологами, просто отличаются на несколько групп CH₂.
Строение алканов
Разберем строение алканов на примере метана (CH₄).
В молекуле метана один углерод связан ковалентными полярными связями с четырьмя атомами водорода. Из-за того, что у углерода валентные электроны находятся на одной s-орбитали и трёх p-орбиталях, происходит sp³-гибридизация.
То есть выравниваются и образуются гибридные орбитали, которые в пространстве находятся под валентным углом равным 109°28'. Поэтому молекула метана имеет форму тетраэдра (пирамида с треугольным основанием).
Вокруг одинарных связей может происходить свободное вращение атомов. Поэтому алканам свойственна изомерия.
Изомерия — это такое явление, когда соединения имеют одинаковый атомный состав и молекулярную массу. Но отличаются по расположению атомов в пространстве и, поэтому имеют разные свойства.
Такие вещества называются изомерами.
Различают оптическую и структурную изомерию.
Для оптической изомерии необходимо, чтобы атом углерода был связан с четырьмя другими атомами или группами атомов. Такой атом углерода называют — хиральным.
я примера возьмём 3-метилгексан:
Но это только на бумаге всё выглядит ровно и линейно. На самом деле в пространстве молекула располагается под углом. А благодаря хиральному углероду образуются пространственные изомеры. То есть две молекулы с одинаковой формулой будут иметь разную пространственную ориентацию.
А чтобы понять, что такое структурная изомерия или изомерия углеродного скелета, возьмём бутан (C₄H₁₀). У него четыра атома углерода, связанных друг с другом ковалентной неполярной связью. Длина связи между атомами будет 0,154 нм. А из-за валентного угла между орбиталями цепочка из углеводов не может располагаться линейно.
При этом в пространстве молекулы могут по разному проворачиваться. То есть будут образовываться поворотные изомеры — конформеры.
Стоит запомнить, что метан, этан, пропан — не имеют никаких изомеров.
При этом в пространстве молекулы могут по разному проворачиваться. То есть будут образовываться поворотные изомеры — конформеры.
Стоит запомнить, что метан, этан, пропан — не имеют никаких изомеров.
А выглядеть изомеры могут так:
Это далеко не все изомеры н-октана (молекулу без разветвлений принято назвать «нормальной», поэтому впереди названия стоит буква «н»).
Возникает вопрос: а как не запутаться? Ху из ху?
Для составления названий используется международная номенклатура ИЮПАК.
Для того, чтобы составить название требуется несколько простых шагов:
- Окидываем ясным взором формулу, которая нарисована перед нами.
- Делим на составляющие.
- Определяем самую длинную цепь из атомов углерода. Сколько там атомов углерода? Пять — значит пентан, восемь — октан. Ответвления от главной цепи называются алкильными радикалами. Они называются точно также, как и алканы с тем же количеством атомов углерода. За исключением суффикса, будет не «ан», а «ил». Например: метил —СН₃, этил —-C₂H₅, пропил C₃H₇ и так далее.
- Нумеруем атомы углерода в главной цепи слева направо.
- Смотрим, у каких атомов углерода есть алкильные радикалы. В нашем примере есть два радикала: у второго атома углерода — метил, а у третьего — этил.
- Составляем название. 2-метил-3-этилпентан.
- Всё, мы великолепны.
Иногда в проверочных, на экзамене или на ЕГЭ можно встретить коварное задание: «Назовите сколько первичных, вторичных и третичных атомов углерода в алкане.»
Что ж, попробуем разобраться.
Первичным называется тот атом углерода, который соединён только с одним атомом углерода.
Вторичным — с двумя, а третичным — с тремя.
Возьмем снова наш пример. Там будет: 4 первичных атома углерода, 2 вторичных, 2 третичных. Итого 8 штук. Не забываем, что число должно совпадать с количеством атомов углерода в формуле.
Физические свойства алканов
С CH₄ до C₄H₁₀ — газы без цвета и запаха. Те, что используются в доме, имеют неприятный запах, но это их специально делают такими пахучими, добавляя меркаптан. Иначе мы бы не заметили утечки.
С С₅H₁₂ до С₁₉H₄₀ — жидкости желтоватого цвета с запахом, похожим на бензин.
С С₂₀Н₄₂ и далее — твёрдые вещества, парафины, бесцветные, без запаха. Такие алканы можно встретить в свечах.
Все алканы плохо растворимы в воде, но могут растворяться в органических растворителях. А у линейных молекул температура и плавления выше, чем у разветвленных.
Химические свойства алканов
1. Реакция горения
Горят алканы без копоти с желтовато-красно-голубым пламенем и выделяют большое количество тепла. Реакция горения, характерна для всех углеводородов. Всегда будет выделяться вода.
C₃H₈+O₂→3CO₂+4H₂O+Q
При неполном сгорании могут образовываться CO и H₂.
2. Реакции разложения
a. Крекинг. Эта реакция идет при нагревании.
C₁₆H₃₄ (гексадекан)→C₈H₁₈ (октан) +C₈H₁₆ (октен) (t=600)
b. Пиролиз метана. Реакция происходит при высоких температурах. В процессе отщепление водорода, т.е дегидрирование углеводорода. Быстрее улетит водород от третичного углерода, затем от вторичного, и только потом от первичного.
CH₄→C+2H₂ (t=1000°C)
2CH₄→C₂H₂ (ацетилен)+3H₂
3. Реакции замещения протекают по свободно-радикальному механизму.
a. Галогенирование (чаще используется хлор, бром). Это фотохимическая реакция, то есть протекает только при свете, а в темноте не происходит. Реакция будет протекать до тех пор, пока углерод не потеряет все связи с водородом.
CH₄+Cl₂→CH₃Cl (хлорметан)+HCl
CH₃Cl+Cl₂→CH₂Cl₂+HCl (дихлорметан)
CH₂Cl+Cl₂→CHCl₃ (трихлорметан, другое название хлороформ)+HCl
CHCl₃+Cl₂→HCl + CCl₄ (тетрахлорметан, совсем не горит, его используют для того, чтобы тушить пожар)
b. Нитрование, реакция Коновалова (взаимодействие с азотной кислотой). Реакция идет при наличие катализатора (H₂SO₄ конц.) и нагревании.
C₂H₆+HNO₃→C₂H₅N0₂ (нитроэтан)+H₂O
Все производные с нитро группой — взрывчатые).
5. Реакция изомеризация.
Она возможна у алканов, начиная с бутана. Нужен катализатор (AlCl₃/ZnCl₂) и нагревание.
Алкильный радикал будет присоединяться только ко второму или предпоследнему углероду в цепи.
6. Реакции присоединения
Не будут протекать. У алканов и так все связи насыщены до предела.
7. Каталитическое окисление.
(Получение кислородсодержащих продуктов)
2C₄H₁₀ (бутан) +5O₂→4CH₃COOH (уксусная кислота) +2H₂O
8.Паровая конверсия метана, реакция идёт в присутствии катализатора и при нагревании.
CH₄+H₂O→CO+3H₂ (образуется синтез-газ. Имеет важное промышленное значение).
Получение алканов
Алканы можно выделить из природных источников. Например, в составе природного газа содержатся: метан, этан, пропан, бутан.
Когда добывают нефть, то над ней находится как бы воздушная шапка — попутный нефтяной газ. Он состоит из нескольких фракций. «Сухой газ» этан+метан, пропан-бутановая смесь и газовый бензин (пентан + гексан). Но выделять такой газ довольно трудно, поэтому чаще всего его сжигают.
В составе самой нефти содержатся алканы с количеством углеводов от 1 до 70. Ещё в ней есть ароматические углеводороды, циклоалканы (нафтены).
Кроме того, алканы можно синтезировать.
В условиях лаборатории в основном используется два метода:
1) Метод Муассана. Получение метана при гидролизе карбида алюминия. Реакция необратимая.
Al₄C₃ + 12H₂O → 4Al(OH)₃ + 3CH₄
Al₄C₃ + 12HCl → 4AlCl₃ + 3CH₄ (в кислой среде)
2) Реакция Дюма.
Взаимодействие карбоновых кислот с щелочами, в результате происходит декарбоксилирование кислот):
СH₃COONa + NaOH (тв.) → CH₄ + Na₂CO₃ (t°C)
Для получения большого количества алканов в промышленных целях используют:
1) Процесс Фишера-Тропша. Получение углеводородов на основе «синтез-газа» (смесь CO и H₂) при участии катализаторов (Ni, Fe, Co, Ru). Так получают жидкое топливо из газов. Реакция идет с выделением тепла.
nCO +(2n+1) H₂ → CnH₂n+₂ +nH₂O
2) Гидрирование угля, реакция. Понадобится нагревание и металлический катализатор (например, Ni):
С + 2H₂ → CH₄ (t°C, p, кат.)
3) Реакция Кольбе
Электролиз растворов солей карбоновых кислот:
2СH₃COONa + 2H₂O → СH₃-СH₃ + 2CO₂ + H₂ + 2NaOH (эл. ток)
4) Реакция Вюрца (мы ее уже разбирали в химических свойствах алканов):
СH₃Сl + 2Na + ClСH₃ → 2NaCl + СH₃-СH₃ (t°C)
Применение алканов
- Алканы входят в состав природного газа, который мы используем для приготовления пищи, обогрева жилплощади, в качестве топлива для автомобилей.
- Алканы есть в бензине, керосине. Используются для изготовления смазок, пластмасс, красок, бытовой химии.
- Гептан и октан применяются, как неполярные растворители.
Проверь себя
Какая формула будет у алкана с 11 атомами углерода?
- C₁₁H₁₇
- C₁₁H₂₂
- C₁₁H₂₄
Какую форму имеет молекула метана?
- Куба
- Тетраэдра
- Шара
C₁₀H₂₂ жидкость, газ или твердое вещество?
- Жидкость
- Твердое вещество
- Газ