Углерод

Введение
Вся жизнь на планете Земле основана на углероде. Попробуем разобраться, как он, такой маленький, с этим справляется.

Углерод. Общие сведения
Углерод — это шестой элемент таблицы Д. И. Менделеева. Он с комфортом расположился в главной подгруппе IV группы (или в 14 группе согласно современной периодической системе химических элементов) и во втором периоде.
На внешнем электронном уровне углерод имеет 2 неспаренных электрона и 1 электронную пару.
В основном состоянии электронная конфигурация выглядит так:
Из этого следует, что углерод может участвовать в образовании двух химических связей по обменному механизму, и его валентность будет II.
А с помощью спаренных электронов элемент может образовать ещё одну химическую связь, но уже по донорно-акцепторному механизму, а валентность соответственно будет III.
При поглощении энергии пара электронов внешнего уровня рассматривается, и один электрон переезжает в новую квартиру. А углерод переходит в возбужденное состояние и теперь имеет четыре валентных электрона. Электронная конфигурация теперь будет следующая:
Теперь углерод в состоянии вступить сразу в четыре химических связи по обменному механизму, а его валентность будет IV.
Именно эта способность позволила углероду породить множество различных соединений, да так, что пришлось даже выделить ему отдельный раздел — органическую химию.
Степеней окисления тоже будет несколько: -4 до +4. Ниже в таблице приведены примеры соединений.
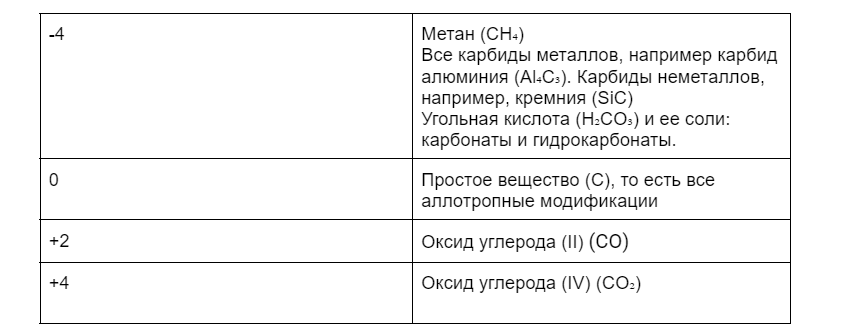
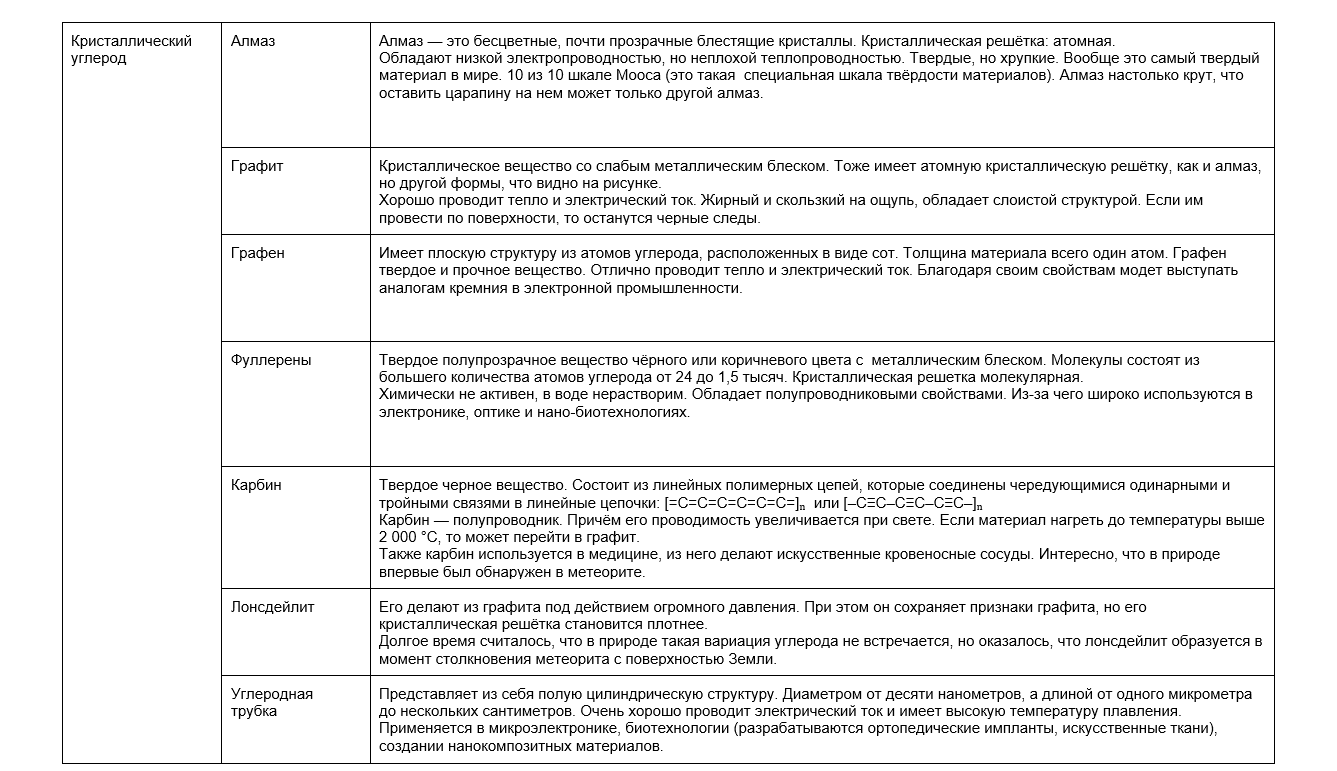
Физические свойства и аллотропия углерода
Углерод неметалл, а как и большинству неметаллов ему свойственна аллотропия. Самыми популярными природными аллотропными модификациями будут алмаз, графит, уголь, антрацит. Некоторые вариации можно получить только искусственно. Ниже в таблице рассмотрим особенности разных видов углерода.

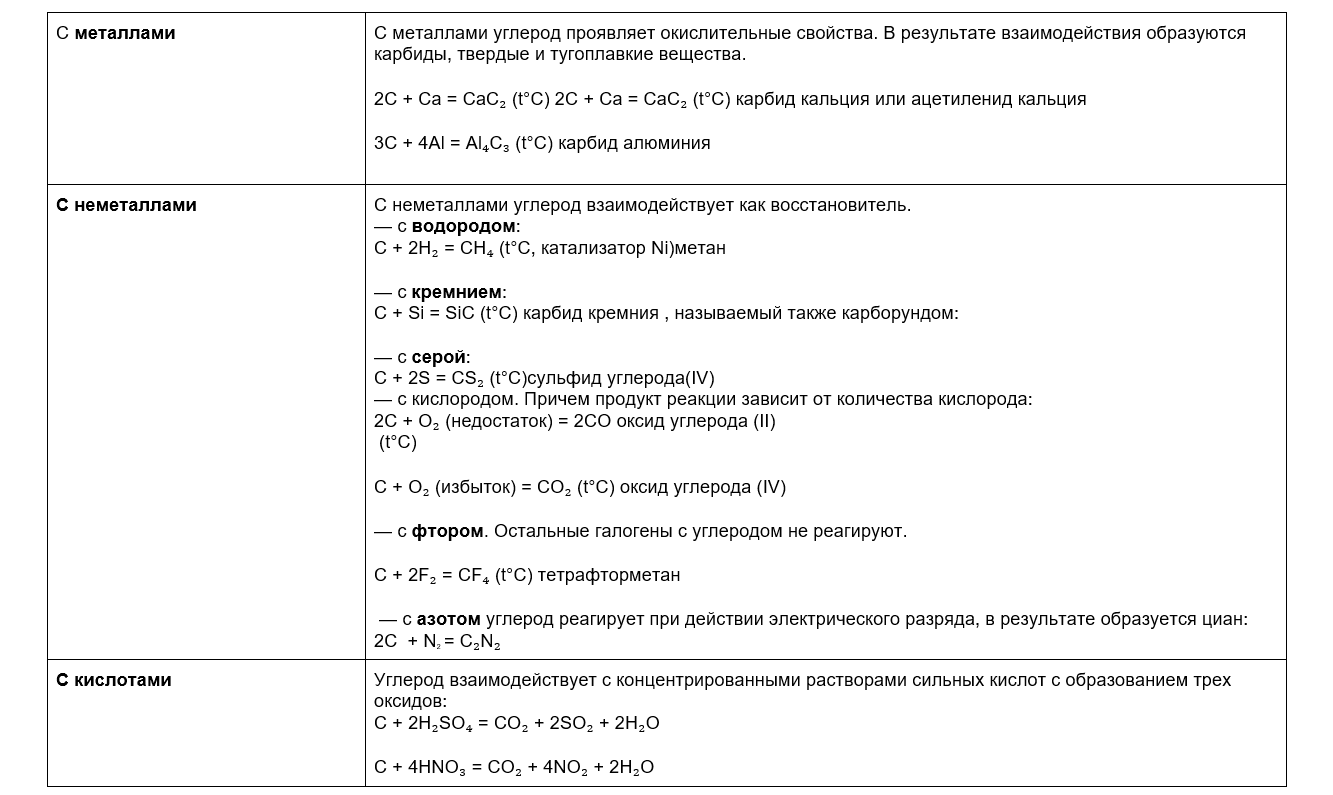
Химические свойства углерода
Углерод не особо химически активен. Чтобы хоть как-то заставить его вступать в реакции, приходится прибегать к ухищрениям: то катализатор добавить, то горелку включить.

Способы получение углерода
Углерод добывают в природе в виде угля, алмазов, графита, а также его можно получить из сложных органических соединений.
В промышленности в основном применяют пиролиз метана:
CH₄ = C + 2H₂.
Соединения углерода
Соединений углерода великое множество, вся органическая химия, по своей сути, об этом. Но это всё потом, к сейчас рассмотрим пару оксидов, угольную кислоту и ее соли.
1. Оксид углерода (II) или угарный газ.
CO — газ без цвета и запаха. Ядовитый. Это несолеобразующий оксид, он не взаимодействует с щелочами (но может с твёрдыми, например с KOH), кислотами, мало растворим в воде. Образуется при сгорании дров, угля, бензина, природного газа в условиях недостатка кислорода.
2. Оксид углерода (IV) или углекислый газ
CO₂ — бесцветный газ без запаха. Наш постоянный спутник, так как образуется в процессе дыхания. В больших количествах может вызвать удушье. При низкой температуре и высоком давлении переходит в твёрдое агрегатное состояние, и в таком виде известен под названием «сухой лед». Это кислотный оксид, в воде растворяется с образованием слабой угольной кислоты H₂CO₃.
3. Угольная кислота
H₂CO₃ — двухосновная кислота.
Образует два вида солей:
1. Карбонаты — белые кристаллические вещества, в основном плохо растворимые в воде, кроме карбоната калия, натрия и аммония. В результате взаимодействия с кислотами на поверхности раствора появляются пузырики, это выделяется углекислый газ.
Остановимся на паре представителей. K₂CO₃ — карбонат калия или поташ, применяется в качестве проявителя в фотографии, а также для изготовления жидкого мыла, тугоплавкого стекла.
А карбонат кальция CaCO₃ более известен, как кальцит, мел или известковый шпат. Входит в состав экзоскелета и эндоскелета. Используется в металлургии, медицине, оптике.
2. Гидрокарбонаты — как и карбонаты, белые кристаллические вещества, но в отличие от них, очень хорошо растворимые в воде. Например, всем известная питьевая сода, это гидрокарбонат натрия (NaHCO₃). Где ее только не применяют. В кулинарии, в быту, в промышленности. Универсальная вещь. И блины испечь, и сковородку отмыть.
Применение углерода
Отраслей применения углерода ещё больше чем его аллотропных модификаций и различных соединений. Перечислим основные.
- Углерод используется в производстве чугуна.
- Угли применяются для получения металлов, карбидов.
- Сажа необходима в производстве резины, пластмассы, типографской краски, копировальной бумаги.
- Графит используется при создании электродов, нагревательных элементов, полупроводников, стержней для карандашей, смазочных материалов.
- Бриллианты — это ограненные алмазы. Из них делают ювелирные украшения, и цена на них сильно кусается. К слову, бриллиант размером в 59,6 карата был продан за 83 миллиона долларов.
- Есть ещё искусственные алмазы, которые получают при высоком давлении из других углеродных соединений. Как и природный аналог, они обладают большой твердостью. Поэтому применяются для создания режущего и шлифовального инструмента. Например, наконечники с алмазным напылением можно найти в кабинете стоматолога.
Проверь себя
Какая аллотропная модификация углерода оставляет черный след на поверхности?
- алмаз
- графит
- сажа
Если углерод в угарном газе образовал три химических связи, то какая у него будет валентность?
- I
- III
- IV
Соединения углерода с металлами называются?
- Карбиды
- Карбонаты
- Карбонары