Неметаллы

Введение
На языке терминов, неметаллы — это химические элементы, которые обладают свойствами, отличными от металлов.
Сразу всё понятно? Нет. Звучит так же, как «шаурма — это штука, которая не имеет свойств беляша».
Получается, чтобы рассказать про неметаллы, нужно всегда помнить о металлах.
Просто те известны человеку с незапамятных времен. Их использовали для изготовления оружия, брони, посуды. Металлы блестят, плавятся, можно и ножичек сделать и колечко выковать. Поэтому не долго думая, все остальные вещества, которые вроде бы другие, люди назвали – неметаллы. Никакой фантазии.
Неметаллы в химии. Общая характеристика
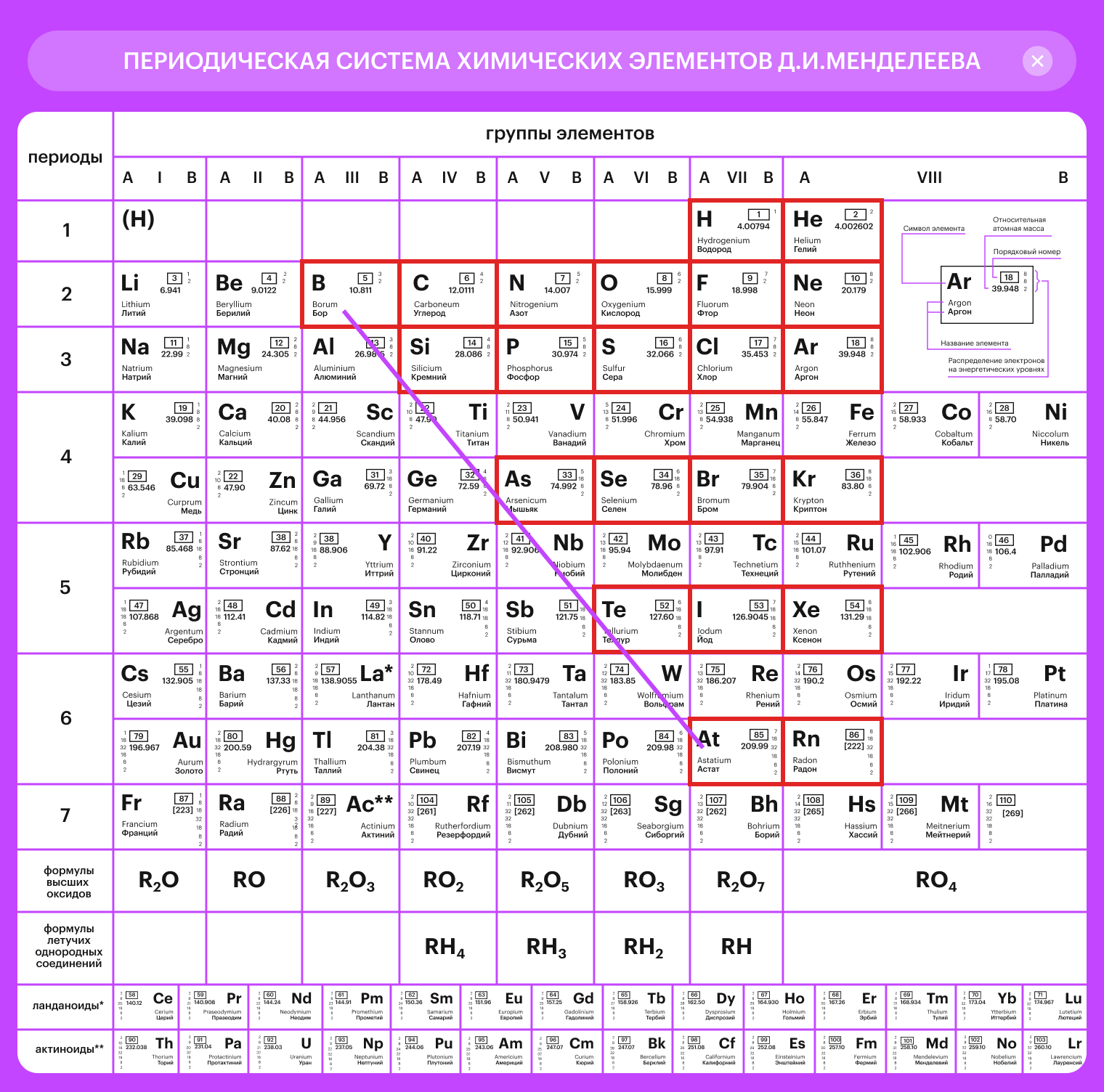
Для того, чтобы найти неметаллы, обратимся таблице Д.И. Менделеева.
Проведем условную линию через следующие элементы: водород (H), бор (B), кремний (Si), мышьяк (As), теллур (Te), астат (At).
К неметаллам будут относиться все элементы выше условной линии, располагающиеся в главных подгруппах. Итого: 22 штуки.
А именно:
Среди них есть два s -элемента (водород и гелий), то есть на их внешнем электронном уровне находятся s-электроны. Все остальные неметаллы относятся к p-элементам, по аналогии, на их внешнем электронном уровне находятся p-электроны.
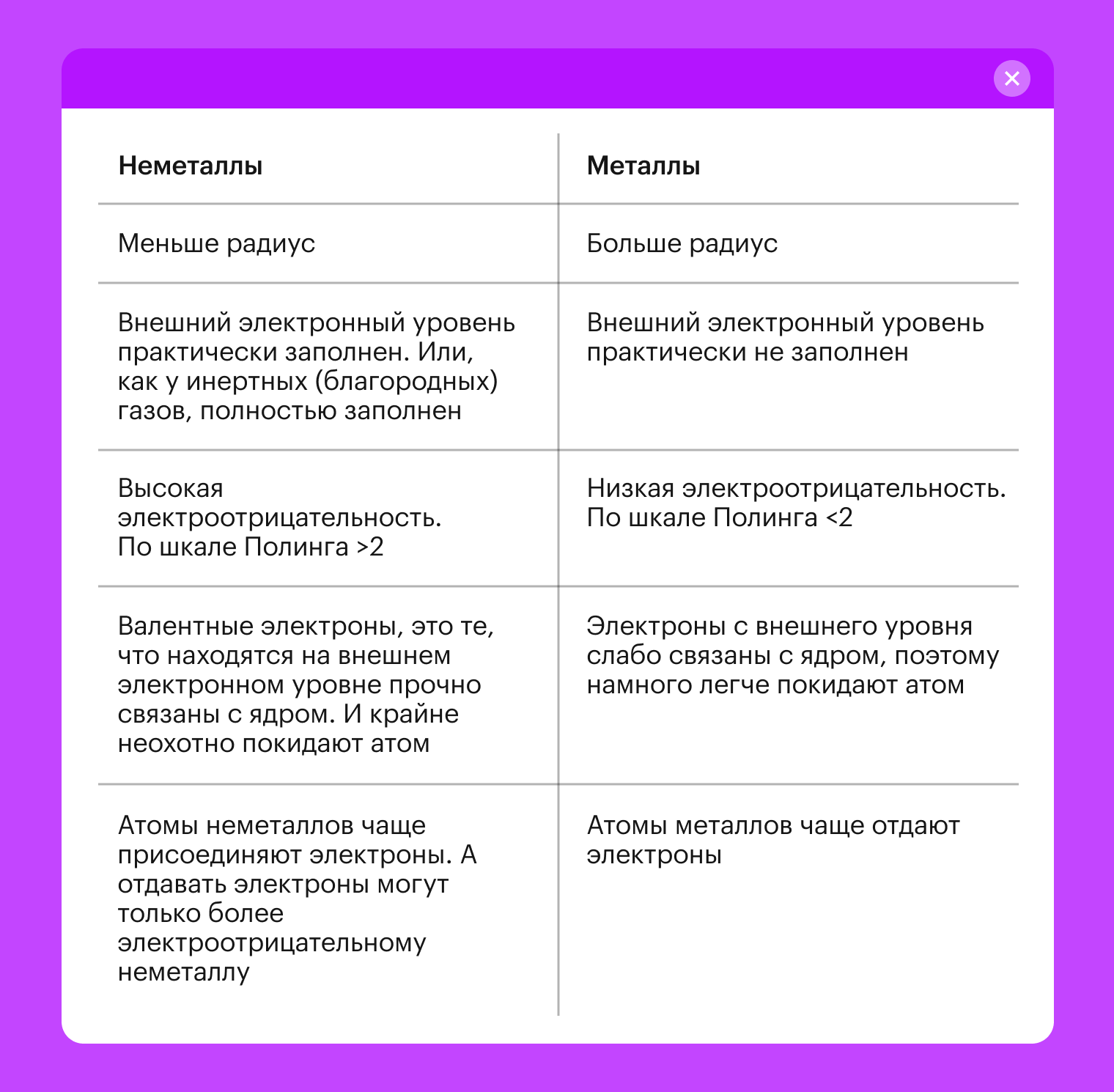
Кроме того, атомы неметаллов имеют некоторые отличия от атомов металлов. Чтобы их разобрать, обратимся к табличке ниже:
Физические свойства неметаллов. Аллотропия
Снова вспомним про металлы. Какие они?
- Обычно это твердые вещества (кроме ртути, она при комнатной температуре жидкая).
- Обладают хорошей ковкостью и пластичностью.
- Имеют металлический блеск.,
- Хорошо проводят тепло и электрический ток.
А неметаллы, на то и называются неметаллами, потому что совсем не металлы.
- При обычных условиях они могут быть газообразными (кислород, водород, инертные газы), твердыми веществами (углерод, фосфор, сера), в виде жидкости (бром – это единственный представитель, стоит запомнить).
- Довольно хрупкие, колечко выковать не получится.
- Не имеет блеска, кроме графита (это разновидность углерода) и йода.
- Плохо проводят тепло. Электропроводность низкая. За исключением графита, кремния (он относится к полупроводникам) и черного фосфора.
- Неметаллам свойственно явление аллотропии.
Аллотропия – это образование одним и тем же химическим элементом нескольких простых веществ. такие простые вещества называются – аллотропными модификациями.
Проще говоря, это когда начинка одна, а вид разный. Разберем на простом примере. Вот есть макароны по-флотски, пельмени и один чебурек. Совершенно разные блюда. Вид, вкус всё другое, даже способ приготовления. Но по сути-то ведь в их составе всего-лишь тесто и мясо.
Вот и в химии также. Например, химический элемент кислород (O) в природе встречается в виде простого вещества кислорода (O₂) и озона (O₃). Причем озон – это газ, имеющий светло-синий цвет и запах. А кислород – это бесцветный газ без запаха, им-то мы и дышим.
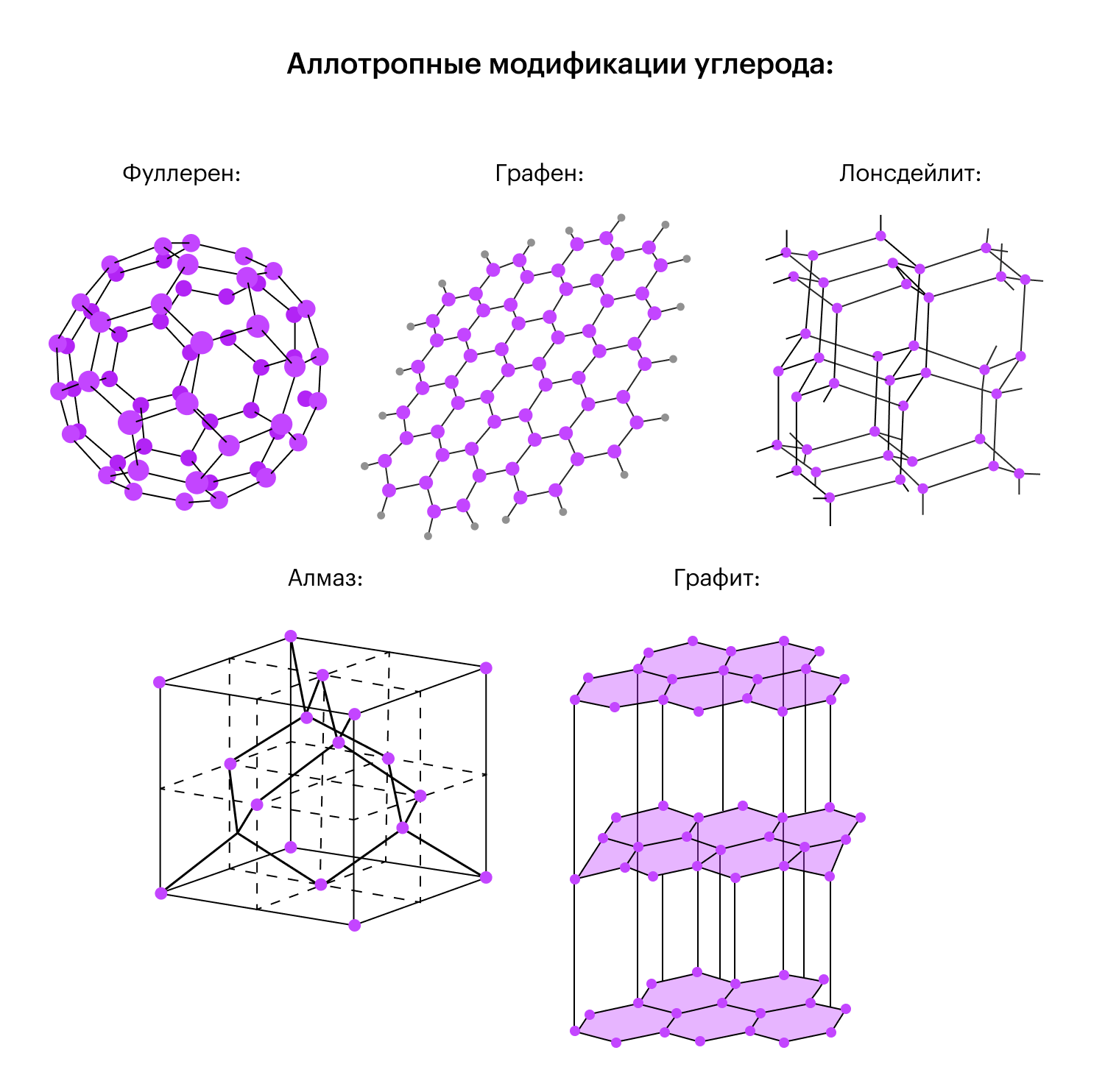
У углерода таких аллотропных модификаций целая куча: алмаз, графит, фуллерен, кокс, сажа, карбид, лонсдейлит.
В это трудно поверить, но и алмаз, и графит имеют в составе один и тот же химический элемент — углерод.
Сера тоже имеет аллотропные модификации: моноклинная, ромбическая, пластическая.
Причем, самой устойчивой формой является ромбическая сера.
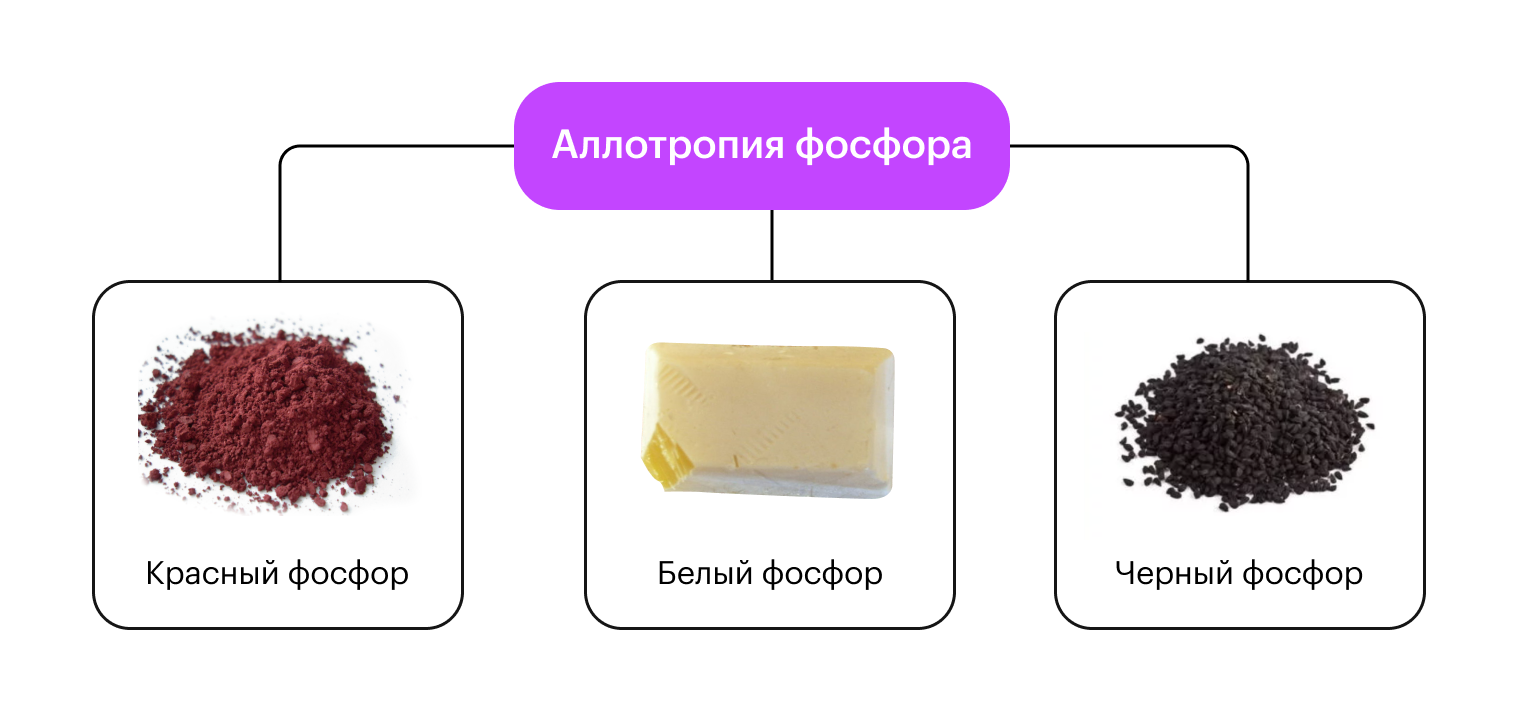
Аллотропия фосфора: красный, белый, черный.
Например, белый фосфор, светится в темноте, крайне ядовит и может самовоспламеняться на воздухе. А вот красный фосфор такими характеристиками не обладает. Черный фосфор имеет хорошую электропроводность и химически инертен.
Стоит упомянуть, что неметаллы могут иметь:
- молекулярное строение, то есть состоят из молекул. Связи между ними очень слабые, поэтому такие вещества непрочные, имеют низкую температуру плавления и кипения, в обычных условиях чаще жидкости (Br₂) или газы (Xe, O₂, Cl₂), но могут быть и твердыми веществами ( белый фосфор (P₄), ромбическая сера (S₈), фуллерен (C₆₀), йод (I₂).
- немолекулярное строение, это когда частицы (атомы, ионы) в веществе прочно связаны химическими связями. Поэтому все неметаллы с немолекулярным строением твердые вещества (алмаз, графит, Si, As). Для них свойственны крайне высокие температуры кипения и плавления, например, алмаз плавится при температуре 4000°C. Для сравнения температура плавления серы (S₈) будет 112,8°C.

Химические свойства неметаллов
Неметаллы могут проявлять окислительные и восстановительные свойства. Исключением будет только фтор (F) — он всегда окислитель, ведь имеет самую большую степень электроотрицательности.
Окислительные свойства элементов увеличиваются прямопропорционально величине электроотрицательности.
Только окислительные свойства неметаллы будут проявлять в реакциях с металлами:
Ca + Cl₂ = CaCl₂ (хлорид кальция)
При взаимодействии двух неметаллов, один из них будет проявлять окислительные свойства, а другой восстановительные:
2F₂ + O₂ = 2OF₂ (фторид кислорода)
В этой реакции фтор является окислителем, а кислород восстановителем. Кстати, фтор единственный галоген, который реагирует с кислородом.
C + O₂ = CO₂ (углекислый газ)
А здесь уже кислород проявляет окислительные свойства, а углерод восстановительные.
3H₂ + N₂= 2NH₃ (аммиак)
C + 2Cl₂ = CCl₄ (тетрахлорметан)
Благородные газы долгое время считались химически инертными, то есть веществами, которые не участвуют в химических реакциях. Ведь их внешний электронный уровень полностью забит электронами. Именно поэтому их и назвали инертными газами. Но оказалось, что они тоже могут при определённых условиях взаимодействовать с фтором, кислородом и проявлять восстановительные химические свойства. Например, при дневном свете, нагревании под давлением с добавлением катализатора, или при воздействии электрического разряда и ультрафиолетового облучения. В таких условиях ксенон очень неохотно может поделиться электронами с фтором. В результате образуются фториды ксенона: XeF₂, XeF₄, XeF₆. А чтобы получить фторид криптона (KrF₂) может потребоваться не только электрический ток, но и продолжительное радиоактивное излучение вместе с охлаждением.
Xe + F₂ = XeF₂ (реакция происходит при дневном свете).

Способы получения неметаллов
Многие неметаллы можно найти в природе либо в виде соединений, сплавов, либо в свободном состоянии, например, кислород, азот, инертные газы. Кроме того, в свободном состоянии можно обнаружить самородную серу, углерод в виде алмазов и графита.
Чистый углерод получают методом пиролиза, разложения органических веществ под действием высоких температур и при отсутствии кислорода.
Реакция протекает при температуре 1000 °С
Кислород и азот получают методом криогенной ректификации воздуха. Воздух сначала сжижают и остужают до – 200°С, а потом нагревают в результате чего постепенно испаряется сначала азот, потом аргон, а следом кислород.
Чистый кремний получают из оксида кремния (кремнезема):
SiO₂ + 2Mg = Si + 2MgO
SiO₂ + 2C= Si + 2CO
Хлор получают с помощью метода электролиза раствора или расплава хлорида натрия:
Применение
Неметаллы используются:
- Для производства полупроводников (селен (Se), кремний (Si).
- Углерод и водород для получения чистых металлов из их оксидов (вольфрам, молибден, ниобий). Восстановление металлов из руд, сплавов (бор, кремний).
- Создание инертных сред для химических лабораторий, хранения реагентов (благородные газы, азот).
- Лампы тлеющего света заполняют инертными газами, чаще неоном (Ne), он дает красновато-оранжевое свечение.
- Сера применяется в производстве резины.
- Для создания топлива. Неметаллы входят в состав экологически чистого — водородного топлива, и не очень экологичного бензина.
- В сельскохозяйственной отрасли неметаллы входят в состав удобрений (азот), а сера используется для подкисления почвы, а также для борьбы с грибковыми заболеваниями растений и растительноядными клещами.
- В медицине требуется кислород при хронических заболеваниях дыхательной системы и для оказания неотложной помощи. В виде кислородных подушек или кислородного концентратора.
- В пиротехнике применяют фосфор, сера, древесный уголь.
- Для дезинфекции воды используются хлорные таблетки, которые содержат активный хлор. А также он содержится во многих моющих средствах.
Проверь себя
Какой неметалл проявляет только окислительные свойства?
- фтор;
- хлор;
- кислород;
- теллур.
У кого больше радиус атома?
- у неметалла;
- у металла;
- одинаковый у обоих.
Кто из элементов проявляет неметаллические свойства?
- Cu;
- Mo;
- Te.